PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc
|
|
|
- Rosalia Valeria Bertolini
- 5 anni fa
- Visualizzazioni
Transcript
1 1 TITOLO: PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc METODO: STANDARDIZZAZIONE a) mediante sostanza madre FeSO4 7H20 b) mediante sostanza madre (COOH)2 2H20 b1) con metodo BRIGHT ( diretto) b2) con metodo FOWLER indiretto RISULTATI: fc=vt/vp Pesare 1,58gr di KMnO4(PM=158g), scioglierli in H20 e portarli a volume con H2O in un matraccio da 2l; a) Pesare 0,695g di FeSO4 7H20(PM=278g), scioglierli in H2O e portarli a volume in un matraccio da 100m1. Prelevare 20 ml, aggiungere 4ml di H2S04 2N e titolare a freddo con KMnO4 0,025N fc(v1). b) Pesare 0,157g di (COOH)2 2H20(PM=126g), scioglierli in H2O e portarli a volume in un matraccio da 100m1. b1) metodo BRIGHT: prelevare 20ml, aggiungere 20ml di H2O, 2ml di H 2 SO 4 e titolare con KMnO4 0,025N fc fino a viraggio dall incolore al rosa persistente per 2 (V1). b2) metodo FOWLER indiretto: prelevare 20ml, aggiungere 0,90 V1 ml di KMnO4 0,025N fc, 4ml di H2S04 2N e riscaldare fino a decolorazione, titolare a caldo con KMnO4 0,025N fc fino a viraggio(0,1 V1)
2 2 REAZIONI: 5 Fe 2+ +MnO H + = 5 F e +3 +Mn H2 0 2KMnO4+5(COOH)2+3H2S04----! 2MnSO4+10C02 + 8H20+ K2S04 a) PE FeSO4 7H20 =PM= 278g PE N:IOOO =0,695g: Vt fc= Vt Vp = (V1 KMnO4 0,025N fc 5) Vp b1)pe= V/2 PM= 126 g(cooh)2 2H20 = 63g PE N: = 0,157g :Vt fc=vt/vp b2) V1= 0,9 V 1 + 0,1V1 pesafiltro, bilancia analitica, spatola, imbuto, pipetta, matraccio da 100ml, buretta, beuta, bunsen, matraccio da 21. SOSTANZE: KMnO4, FeSO4 7H20(s), (COOH)2(s), H2S04 2N, H20 distillata, KMnO4 0,025N fc..
3 3 TITOLO: dosaggio del Ferro METODO: titolazione con KMnO4 0,025N fc SINTESI DEI DATI: % in gr di Fe Prelevare 7-15ml di SC e portare a volume in matraccio dal 100ml con H20 distillata. Prelevare 20ml, aggiungere 20ml di H20 distillata, 4ml di H2S04 2N e titolare a freddo con KMnO4 0,025N fc fino a viraggio (V1)(incolore-viola) REAZIONI: 5Fe 2+ + MnO H + = 5Fe 3+ +Mn H20 5 MnO H + = Mn ++ +4H20 5Fe 2+ =5Fe 3+ PE=PA=55,85 PE N : IOOO = x%gr :V1 fc 5 x % = % in gr di Fe imbuto, pipetta, matraccio da 100m1, buretta, beuta, SOSTANZE: H2S04 2N, H20 distillata, KMnO4 0,025N fc, FeSO 4 7H2O.
4 4 TITOLO: dosaggio dell acido ossalico METODO: per TITOL4ZIONE con KMnO4 0,025 N fc. SINTESI DEI DATI : % in gr di (COOH) 2 2H2O. X ml di sc vengono portati a volume in un matraccio tarato da 100ml con H2O. Si prelevano 20 ml., si introducono in un becker, si aggiungono 25 ml di H2O, 2 ml di H2S04 2N; si riscalda a bagnomaria fino ad 70 C e si titola a caldo con KMnO4 O,O25 N fc fino al viraggio(v). 5(COOH)2+ 2KMnO4+3H2S04 2M-nSO4 +K2S04+ 10C02+8H20 Pe = PM/2 = 126/2 g PE N: 1000 =X gr. %: V fc 5 X gr. % = % di acido ossalico in soluzione buretta, matraccio da 100ml, imbuto beacker, bunsen.
5 5 REAGENTI: ac. ossalico, H2SO4 2N, KmnO4 0,025N fc. OSSIDIMETRIA TITOLO: DOSAGGIO dei BROMURI METODO: TITOLAZIONE con KMn04 0,025 N fc. SINTESI DEI RISULTATI: % in gr di Br. Prelevare 7-15ml di SC e portare a volume in matraccio dal 100ml con H 2 0 distillata. Si prelevano 20 ml. di S.C. di Bromuro, si introducono in un becker, si aggiungono 2 ml di H2S04 4 N e 20 ml di
6 6 acqua distillata, si riscalda a C e si titola con KMnO4 0,025 N fc fino al viraggio( V). 10 KBr + 2 KMnO4 +8 H2S04 -!2 MnSO4+6K2S04+ 5 Br2 +8H20 Pa = Pe = 80gr Pa N: 1000 = X gr. %: V fc 5 X gr. % = % in gr di Br. NOTA: al p.e. si forma un intorbidamento bruno della soluzione per cui il colore di viraggio non è rosa ma un colore scuro dovuto alla formazione della molecola di Br2 buretta, matraccio da 100ml, imbuto, beacker. REAGENTI: S.C. di Bromuro, H2SO4 4N, KMnO4 0,025 fc. OSSIDIMETRIA TITOLO: DOSA GGIO dell acqua ossigenata
7 7 METODO: TITOLAZIONE con KMn04 0,025 N fc. SINTESI DEI DATI: a) % in gr di H 2 O 2 ; b) volumi di O 2. Prelevare 7-15ml di SC e portare a volume in matraccio dal 100ml con H20 distillata. Si prelevano 20 ml di S.C. di H2O2, si introducono in un becker, si aggiungono 2 ml di H2SO4 4 N, 20 ml. di acqua distillata e si titola con KMnO4 0,025 N fc (V) fino a viraggio da incolore al rosa. a) 2 KMnO4+5H H 2 SO4 2 MnSO4 + K 2 S H20 b) H (34gr) H 2 O + ½ O 2 (11.200ml) Pe = PM/2 = 34/2 = 17gr a)17 N: 1000 = gr. %: V fc 5 gr. % = % in gr di H 2 O 2 b)volumi di 0 2 : y = volumi di O 2. 34gr : 12000ml = % gr(h ): y
8 8 Buretta da 50 ml, matraccio da 100 ml, imbuto, becker. REAGENTI: S.C. di H202, H2S04 4N, KMnO4 0,025 fc, acqua distillata. TITOLO: preparazione e standardizzazione di 2l di soluzione di acido ossalico 0,025 N METODO: Titolazione con KMnO4 0,025 N fc. SINTESI DEI DATI : fc =Vt (ml KMnO4 0,025Nfc) Vp (ml (COOH)2 0,025 N Si pesano 0,15gr di Acido Ossalico(PM=126gr) si sciolgono in H2O e si portano a volume di 100ml(S.M.). Si prelevano 20ml di S.M.(Vp), si introducono in un becker, si aggiungono 2 ml. di H2S04 N e 10 ml. di acqua
9 9 distillata: si riscalda a bagnomaria fino ad 70 C e si titola a caldo con KMnO4 O,O25 N fc fino al viraggio(vt). 5(COOH)2+ 2KMnO4+ 3H2S04 +K2S04+ 10C02+8H20 2MnSO4 Pe = PM/2 = 126/2 fc = Vt(ml KMnO4 0,025Nfc)/ Vp(ml (COOH)2 0,025 N buretta, matraccio da 100ml, imbuto beacker, bunsen. REAGENTI: ac. ossalico, H2SO4 2N, KmnO4 0,025N fc OSSIDIMETRIA TITOLO: DOSAGGIO dei NITRITI METODO: TITOLAZIONE con KMnO4O, 025 N fc
10 10 SINTESI DEI DATI: % in gr di NaNO 2 PROCEDIMENTO. Prelevare 7-15ml di SC e portare a volume in matraccio dal 100ml con H20 distillata. Si prelevano 20 ml. di S.C. di Nitritì, si introducono in un becker,, si aggiungono 20 ml. di KMnO4 0,025 N fc (Va) e 2 ml. di H2S04 4N.La soluzione è viola scuro. Si riscalda a 40 C fino a lieve decolorazione della soluzione. Si aggiungono 15 ml. di H 2 C 2 O 4 0,025 N fc, si riscalda a 70 C fino a completa decolorazione e si titola con KMnO 4 0,025 N fc (Vb) fino a viraggio. 5 NaNO2+ 2 KMnO 4 +3H 2 S ! 2 MnSO 4 + K 2 S NaNO 3 +3H20 Pe = P.M./2 = 46/2 PE N: 1000 = gr. %: [(Va+ Vb)fc - (V H 2 C 2 O 4 0,0025 fc,)] x 5 gr. % = % in gr di NaNO 2 buretta, matraccioda100ml,imbuto,beacker,bunsen. SOSTANZE: s.c. di Nitriti, H2SO4 4N, KMnO 4 O,O25 fc, H 2 C 2 O 4 0,025Nfc OSSIDIMETRIA TITOLO: DOSA GGIO del CALCIO METODO: TITOLAZIONE con KMnO4OO25 N fc. SINTESI DEI DATI: % in gr di Calcio
11 11 Si prelevano 10 ml. di S.M. di Ca++, si introducono in un becker,, si aggiungono 2 gocce di M.0, 5 ml di tampone ammoniacale (ph = 10), 5 ml. di soluzione di ammonio-ossalato al 5%, e si riscalda per 30 a 60 C. Si raffredda e si filtra il precipitato con carta da filtro raccogliendo il filtrato in una beuta. Il precipitato raccolto su carta si trasferisce in un beacker e si solubilizza con H2S04 (1 : 4) Si trasferisce con imbuto la soluzione acida privata del filtro di carta nel matraccio e si porta a volume a 100 ml. Si prelevano 20 ml. di s.c., si introducono in un beacker, si aggiungono 10 ml. di H20 e si riscalda a 60 C. Si titola a caldo con KMnO 4 0,025 N fc fino a viraggio(v). Ca C CaC CaC H + H2C204 + Ca 2+ 5 H2C KMnO4 + 3 H2S ! K2S04 +2 MnSO4 + 10C H20 Pe = Pa/2 = 40gr/2 PE N: 1000 = X gr. % : V KMnO 4 0,025 N fc 5 X gr. % = % in gr di Calcio Buretta da 50 ml, Imbuto,Becker,Becco Bunsen, carta da Filtro, Beuta SOSTANZE: H2S04, KMnO4 0,025 fc, Acqua distillata, M.0.,Tampone ammoniacale, Ammonio-ossalato 5%. TITOLO. Dosaggio della sulfanilamide METODO: delle amine aromatiche I, con NaNO2 0,025Nfc (saggio alla tocca).
12 12 SINTESI DEI DATI: % di purezza di sulfanilamide. NH2-C6H4-SO2-NH2 +NaNO 2 /HCl----!N 2 + -C6H4-SO 2 NH 2 -+2KBr--![C 6 H 5 - SO 2 NH 2 ] + +2N 2 +Br 2 [C 6 H 5 -SO 2 NH 2 ] + +Br 2 +2KI--! C 6 H 5 -SO 2 NH 2 +2KBr +J 2 NH 2 N=N+ Cl NaNO2 N2 Br2 + H+ 2KBr SO 2 -NH 2 SO 2 -NH 2 SO 2 -NH 2 Pesare 50mg di sulfanilamide e solubilizzare in 5 ml di HCl 4N riscaldando. Aggiungere 100mg di KBr e trasferire in un beacker contenente ghiaccio titolando con NaNO2 0,025N fc(vp) fino ad avere colorazione azzurra con il saggio alla tocca: intingendo la bacchetta di vetro su una cartina asciutta di amido iodurata (si prepara una carta da filtro precedentemente bagnata di una soluzione acquosa di 1,5g di amido 5 % di KI ed asciugata al buio in stufa a 60 C. PM=172,5 gr = PE PE N : 1000 = 0,050gr : Vt(ml di NaNO2 0,025 N fc) % purezza di sodio nitrito = (Vt-Vp)/Vt 100 REAGENTI: Matraccio da 100 ml,hcl 4N, NaNO2 0,025 x fc, Acqua distillata, sulfonilamide, KBr, cartina di amido iodurata,ghiaccio. Buretta da 50 ml, Imbuto,Becker,, carta da Filtro, Beuta
Esperienza n. 1 TITOLAZIONI ACIDO-BASE
 Esperienza n. 1 TITOLAZIONI ACIDO-BASE Preparazione e standardizzazione di una soluzione circa 0.1 M di HCl Preparazione di 1 L di HCl circa 0.1 M. Utilizzando un cilindro da 10 ml, prelevare X ml di HCl
Esperienza n. 1 TITOLAZIONI ACIDO-BASE Preparazione e standardizzazione di una soluzione circa 0.1 M di HCl Preparazione di 1 L di HCl circa 0.1 M. Utilizzando un cilindro da 10 ml, prelevare X ml di HCl
VOLUMETRIA IODOMETRIA IODOMETRIA DIRETTA = IODIMETRIA. IODOMETRIA (iodimetria): dosaggio dell antimonio e potassio tartrato con I 2 0.
 1 VOLUMETRIA IODOMETRIA IODOMETRIA DIRETTA = IODIMETRIA IODOMETRIA (iodimetria): dosaggio dell antimonio e potassio tartrato con I 2 0.025 N f C IODOMETRIA (iodimetria): dosaggio dell acido ascorbico con
1 VOLUMETRIA IODOMETRIA IODOMETRIA DIRETTA = IODIMETRIA IODOMETRIA (iodimetria): dosaggio dell antimonio e potassio tartrato con I 2 0.025 N f C IODOMETRIA (iodimetria): dosaggio dell acido ascorbico con
ESPERIENZA 4. Permanganometria
 ESPERIENZA 4 Permanganometria Il permanganato di potassio è uno dei titolanti più frequentemente usati nell analisi volumetrica per via redox. Può essere usato in soluzione acida, neutra o leggermente
ESPERIENZA 4 Permanganometria Il permanganato di potassio è uno dei titolanti più frequentemente usati nell analisi volumetrica per via redox. Può essere usato in soluzione acida, neutra o leggermente
OSSIDAZIONI CON PERMANGANATO DI POTASSIO
 OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
Acidimetria (primo giorno)
 Acidimetria (primo giorno) 1. Preparazione di una soluzione di HCl circa 0.1 M da una soluzione di HCl concentrato al 37% (d=1.19g/ml, PM=36.46) Prelevare circa 8.3 ml di HCl concentrato (sotto cappa)
Acidimetria (primo giorno) 1. Preparazione di una soluzione di HCl circa 0.1 M da una soluzione di HCl concentrato al 37% (d=1.19g/ml, PM=36.46) Prelevare circa 8.3 ml di HCl concentrato (sotto cappa)
METODO DI VOLHARD. Nel metodo di Volhard gli ioni argento sono titolati con una soluzione standard di ione tiocianato: Ag + + SCN - AgSCN
 METODO DI VOLHARD Il metodo viene impiegato per la determinazione di ioni alogenuro quali I -, Cl -, Br -. Un eccesso noto di soluzione standard di nitrato di argento AgNO 3 viene aggiunto al campione
METODO DI VOLHARD Il metodo viene impiegato per la determinazione di ioni alogenuro quali I -, Cl -, Br -. Un eccesso noto di soluzione standard di nitrato di argento AgNO 3 viene aggiunto al campione
H N. Mn 2+ +.. Fe 3+ +.. H 2 O
 CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
1. Metodo di Mohr 2. Metodo di Volhard 3. Metodo di Fajans
 ARGENTOMETRIA I metodi argentometrici si basano sulla precipitazione di un sale d argento poco solubile. Come reattivo titolante si impiega una soluzione di AgNO 3. I principali metodi sono: 1. Metodo
ARGENTOMETRIA I metodi argentometrici si basano sulla precipitazione di un sale d argento poco solubile. Come reattivo titolante si impiega una soluzione di AgNO 3. I principali metodi sono: 1. Metodo
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
ESPERIENZA 2. Argentometria
 ESPERIENZA 2 Argentometria Le titolazioni argentometriche riguardano principalmente l analisi degli alogenuri. Il dosaggio di anioni (in particolare Cl - ) che formano con Ag + un sale poco solubile viene
ESPERIENZA 2 Argentometria Le titolazioni argentometriche riguardano principalmente l analisi degli alogenuri. Il dosaggio di anioni (in particolare Cl - ) che formano con Ag + un sale poco solubile viene
SCHEDA per l esperienza ACIDO-BASE
 SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
GARA NAZIONALE DI CHIMICA IX EDIZIONE Novembre 2010 PRATO PROVA PRATICA
 Viale della Repubblica, 9 59100 PRATO POTF010003 Tel. 0574/58981 fax. 0574/589830 e.mail: it.buzzi@scuole.prato.it GARA NAZIONALE DI CHIMICA IX EDIZIONE 16-17 Novembre 2010 PRATO PROVA PRATICA REGOLAMENTO
Viale della Repubblica, 9 59100 PRATO POTF010003 Tel. 0574/58981 fax. 0574/589830 e.mail: it.buzzi@scuole.prato.it GARA NAZIONALE DI CHIMICA IX EDIZIONE 16-17 Novembre 2010 PRATO PROVA PRATICA REGOLAMENTO
Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta.
 Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta. Reattivi: acido acetico; acetato di sodio; idrossido di ammonio e cloruro di ammonio; acqua distillata.
Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta. Reattivi: acido acetico; acetato di sodio; idrossido di ammonio e cloruro di ammonio; acqua distillata.
Metodo VII.1. Determinazione dello ione cloro in assenza di sostanza organica
 METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
PERMANGANOMETRIA GENERALITA :
 PERMANGANOMETRIA GENERALITA : Il permanganato di potassio è l'ossidante più usato nelle analisi volumetriche di ossidoriduzione. VANTAGGI: E' un ossidante forte e quindi sono molte le sostanze che possono
PERMANGANOMETRIA GENERALITA : Il permanganato di potassio è l'ossidante più usato nelle analisi volumetriche di ossidoriduzione. VANTAGGI: E' un ossidante forte e quindi sono molte le sostanze che possono
A) Preparazione di una soluzione di Na 2 S 2 O N (0.1 M)
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Preparazione e standardizzazione di una soluzione di Esercitazione n
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Preparazione e standardizzazione di una soluzione di Esercitazione n
DETERMINAZIONE DUREZZA ACQUA
 DETERMINAZIONE DUREZZA ACQUA Le acque contengono disciolti un gran numero di sali e quindi sono presenti molti cationi metallici, tra cui quelli polivalenti che sono i responsabili della durezza. Contribuiscono
DETERMINAZIONE DUREZZA ACQUA Le acque contengono disciolti un gran numero di sali e quindi sono presenti molti cationi metallici, tra cui quelli polivalenti che sono i responsabili della durezza. Contribuiscono
Esercitazione 1 PEROSSIDI IN OLIO D OLIVA
 Esercitazione 1 TITOLAZIONE ACIDO ACETICO IN ACETO E PEROSSIDI IN OLIO D OLIVA Acido acetico in aceto 2 L esperienza consiste nel misurare il grado di acidità di un aceto. L'aceto è una soluzione acquosa
Esercitazione 1 TITOLAZIONE ACIDO ACETICO IN ACETO E PEROSSIDI IN OLIO D OLIVA Acido acetico in aceto 2 L esperienza consiste nel misurare il grado di acidità di un aceto. L'aceto è una soluzione acquosa
REAZIONI ACIDO-BASE OSSERVARE, DESCRIVERE E DARE UNA SPIEGAZIONE DEI FENOMENI CHIMICI AVVENUTI
 ESPERIENZA 2 REAZIONI ACIDO-BASE OBIETTIVO. L'esperienza serve a completare la presa di contatto con le attrezzature di laboratorio e i reagenti chimici più comuni, verificando le conoscenze acquisite
ESPERIENZA 2 REAZIONI ACIDO-BASE OBIETTIVO. L'esperienza serve a completare la presa di contatto con le attrezzature di laboratorio e i reagenti chimici più comuni, verificando le conoscenze acquisite
Corso di laurea in Farmacia a Ciclo unico (classe LM-13) Programma del corso
 Unità Didattica: Laboratorio di Analisi quantitativa - linea 3 Corso di laurea in Farmacia a Ciclo unico (classe LM-13) AA 2015/2016 Programma del corso Indice delle esperienze di laboratorio: 1. Determinazione
Unità Didattica: Laboratorio di Analisi quantitativa - linea 3 Corso di laurea in Farmacia a Ciclo unico (classe LM-13) AA 2015/2016 Programma del corso Indice delle esperienze di laboratorio: 1. Determinazione
Estrazione di pigmenti vegetali da sostanze naturali
 Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
1 Durezza totale dell acqua
 1 Durezza totale dell acqua Materiale occorrente: una pipetta a una tacca da 100 ml; una buretta di Schellbach; una beuta. Reattivi: soluzione titolata di EDTA sale disodico 0,0100 M; indicatore nero eriocromo
1 Durezza totale dell acqua Materiale occorrente: una pipetta a una tacca da 100 ml; una buretta di Schellbach; una beuta. Reattivi: soluzione titolata di EDTA sale disodico 0,0100 M; indicatore nero eriocromo
GARA NAZIONALE DI CHIMICA XVI EDIZIONE. 5-6 Maggio 2017 CHIETI PROVA PRATICA
 GARA NAZIONALE DI CHIMICA XVI EDIZIONE 5-6 Maggio 2017 CHIETI PROVA PRATICA Pag. 1 REGOLAMENTO DELLA PROVA PRATICA Il punteggio massimo della prova pratica è così suddiviso: 1) 15.00 punti per la determinazione
GARA NAZIONALE DI CHIMICA XVI EDIZIONE 5-6 Maggio 2017 CHIETI PROVA PRATICA Pag. 1 REGOLAMENTO DELLA PROVA PRATICA Il punteggio massimo della prova pratica è così suddiviso: 1) 15.00 punti per la determinazione
SCHEDE ESERCITAZIONI IN LABORATORIO
 SCHEDE ESERCITAZIONI IN LABORATORIO ALCALIMETRIA (dosaggio dell acido fosforico) Ritirare il pesafiltri contenente il potassio idrogeno ftalato (KHC 8 H 4 O 4 ), sostanza madre per la standardizzazione
SCHEDE ESERCITAZIONI IN LABORATORIO ALCALIMETRIA (dosaggio dell acido fosforico) Ritirare il pesafiltri contenente il potassio idrogeno ftalato (KHC 8 H 4 O 4 ), sostanza madre per la standardizzazione
ESPERIENZA 3. Chelometrica
 ESPERIENZA 3 Chelometria I complessoni sono agenti leganti polidentati che formano chelati con i cationi nel rapporto stechiometrico 1:1 e possono quindi essere impiegati in numerose titolazioni. I complessoni
ESPERIENZA 3 Chelometria I complessoni sono agenti leganti polidentati che formano chelati con i cationi nel rapporto stechiometrico 1:1 e possono quindi essere impiegati in numerose titolazioni. I complessoni
ESERCITAZIONI ) Standardizzazione di una soluzione di HCl mediante Na 2 CO 3 2) Dosaggio dei carbonati mediante titolazione con HCl
 ESERCITAZIONI 4+5 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di
ESERCITAZIONI 4+5 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di
ESERCITAZIONI. 1) Standardizzazione di una soluzione di HCl mediante Na 2 CO 3 2) Dosaggio dei carbonati mediante titolazione con HCl
 ESERCITAZIONI 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di HCl
ESERCITAZIONI 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di HCl
CHIMICA GENERALE ED INORGANICA LABORATORIO DI CHIMICA
 CHIMICA GENERALE ED INORGANICA Corso di Laurea in Scienze e Tecnologie per l Ambiente LABORATORIO DI CHIMICA Aprile - Maggio 2014 NORME GENERALII PER LA PREVENZIIONE DEGLII IINFORTUNII 1- Tenere sempre
CHIMICA GENERALE ED INORGANICA Corso di Laurea in Scienze e Tecnologie per l Ambiente LABORATORIO DI CHIMICA Aprile - Maggio 2014 NORME GENERALII PER LA PREVENZIIONE DEGLII IINFORTUNII 1- Tenere sempre
ossidazione/riduzione, ossidante/riducente
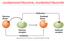 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
Titolazioni Redox. Analisi volumetrica basata su una reazione di ossido-riduzione. La somma delle due coppie coniugate ossido-riduttive
 Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
Sostanze organiche: determinazioni qualitative
 Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml.
 Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
ossidazione/riduzione, ossidante/riducente
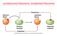 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
CORSO DI LAUREA IN BIOLOGIA ECOLOGICA. Esercitazioni di Laboratorio di Chimica Generale ed Inorganica
 CORSO DI LAUREA IN BIOLOGIA ECOLOGICA Esercitazioni di Laboratorio di Chimica Generale ed Inorganica Anno Accademico 2002-2003 1 ESERCITAZIONE Titolazione di una soluzione di HCl con una soluzione di NaOH
CORSO DI LAUREA IN BIOLOGIA ECOLOGICA Esercitazioni di Laboratorio di Chimica Generale ed Inorganica Anno Accademico 2002-2003 1 ESERCITAZIONE Titolazione di una soluzione di HCl con una soluzione di NaOH
Esperienza n 3: Determinazione del grado di acidità dell aceto commerciale
 Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
Andrea Lorenzi Chiara Ceccarelli
 Andrea Lorenzi Chiara Ceccarelli MATERIALI OCCORRENTI Permanganato di potassio sol. 0,02 M KMNO 4 Acido ossalico sol. 0,1 M (COOH) 2 Acido solforico 95 % H 2 SO 4 Ioduro di potassio sol. 2 M KI Perossido
Andrea Lorenzi Chiara Ceccarelli MATERIALI OCCORRENTI Permanganato di potassio sol. 0,02 M KMNO 4 Acido ossalico sol. 0,1 M (COOH) 2 Acido solforico 95 % H 2 SO 4 Ioduro di potassio sol. 2 M KI Perossido
RIDUTTORI DI JONES E WALDEN Il riduttore di Walden è più selettivo rispetto al jones poiché meno energico L argento non è un buon agente riducente a m
 RIDUTTORI DI JONES E WALDEN Il riduttore di Walden è più selettivo rispetto al jones poiché meno energico L argento non è un buon agente riducente a meno che non sia presente lo ione cloruro che forma
RIDUTTORI DI JONES E WALDEN Il riduttore di Walden è più selettivo rispetto al jones poiché meno energico L argento non è un buon agente riducente a meno che non sia presente lo ione cloruro che forma
RICERCA RICERCA DEGLI ANIONI
 RICERCA DEGLI ANIONI 1 SOSTANZA INIZIALE Na 2 CO 3 Ricerca: ACETATI SOLFITI CARBONATI TARTRATI SOLUZIONE ALCALINA Limpida Incolore RESIDUO Si scarta Ricerca: SOLFATI OSSALATI ARSENIATI NITRITI NITRATI
RICERCA DEGLI ANIONI 1 SOSTANZA INIZIALE Na 2 CO 3 Ricerca: ACETATI SOLFITI CARBONATI TARTRATI SOLUZIONE ALCALINA Limpida Incolore RESIDUO Si scarta Ricerca: SOLFATI OSSALATI ARSENIATI NITRITI NITRATI
Regolamento della Gara Nazionale di Chimica per gli Istituti Tecnici. Regolamento della prova pratica
 Regolamento della Gara Nazionale di Chimica per gli Istituti Tecnici La Gara è costituita da: una prova scritta multidisciplinare con domande a risposta multipla inerenti i programmi delle materie di indirizzo
Regolamento della Gara Nazionale di Chimica per gli Istituti Tecnici La Gara è costituita da: una prova scritta multidisciplinare con domande a risposta multipla inerenti i programmi delle materie di indirizzo
Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M
 Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M CH 3 NH 2 (aq) + H 2 O(l) CH 3 NH 3+ (aq) + OH (aq) K b = [CH 3 NH 3+ ] [OH ] / [CH 3 NH 2 ] = 3,6 * 10-4 [CH 3 NH 2 ] [CH 3 NH 3+ ] [OH ] inizio 0,300
Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M CH 3 NH 2 (aq) + H 2 O(l) CH 3 NH 3+ (aq) + OH (aq) K b = [CH 3 NH 3+ ] [OH ] / [CH 3 NH 2 ] = 3,6 * 10-4 [CH 3 NH 2 ] [CH 3 NH 3+ ] [OH ] inizio 0,300
Farmacopea Europea (European Pharmacopeia)
 LA FARMACOPEA Le Farmacopea Ufficiale della Repubblica Italiana (XII edizione) era un codice farmaceutico, cioè un insieme di disposizioni tecniche ed amministrative rivolte a permettere il controllo della
LA FARMACOPEA Le Farmacopea Ufficiale della Repubblica Italiana (XII edizione) era un codice farmaceutico, cioè un insieme di disposizioni tecniche ed amministrative rivolte a permettere il controllo della
GARA NAZIONALE DI CHIMICA XV EDIZIONE Aprile 2016 PRATO PROVA PRATICA
 MECCATRONICA ED ENERGIA ELETTRONICA ED ELETTROTECNICA INFORMATICA E TELECOMUNICAZIONI Viale della Repubblica, 9 59100 PRATO - Tel. 057458981 Fax 0574589830 Cod. Fisc.84004990481 Part. IVA 00337080972 http://www.itistulliobuzzi.it
MECCATRONICA ED ENERGIA ELETTRONICA ED ELETTROTECNICA INFORMATICA E TELECOMUNICAZIONI Viale della Repubblica, 9 59100 PRATO - Tel. 057458981 Fax 0574589830 Cod. Fisc.84004990481 Part. IVA 00337080972 http://www.itistulliobuzzi.it
Metodiche di Analisi Chimica Quantitativa
 Metodiche di Analisi Chimica Quantitativa GRAVIMETRIA Determinazione gravimetrica del Ba come BaSO 4 Reattivi: HCl conc., H 2 SO 4 2N, Whatman n 42 Si trasferisce la soluzione in becher da 400 ml e si
Metodiche di Analisi Chimica Quantitativa GRAVIMETRIA Determinazione gravimetrica del Ba come BaSO 4 Reattivi: HCl conc., H 2 SO 4 2N, Whatman n 42 Si trasferisce la soluzione in becher da 400 ml e si
COMPLESSI coppia di elettroni liberi Ammoniaca L
 COMPLESSI Molti cationi formano complessi in soluzione con sostanze che abbiano una coppia di elettroni liberi (es. atomi di N, O, S) capaci di soddisfare il numero di coordinazione del metallo. Me = metallo
COMPLESSI Molti cationi formano complessi in soluzione con sostanze che abbiano una coppia di elettroni liberi (es. atomi di N, O, S) capaci di soddisfare il numero di coordinazione del metallo. Me = metallo
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I
 Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO
 RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
A) Determinazione gravimetrica di manganese(ii) e di zinco(ii)
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Determinazione della percentuale di manganese(ii) e Esercitazione n 15
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Determinazione della percentuale di manganese(ii) e Esercitazione n 15
Sostanze inorganiche: determinazioni qualitative
 Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale
 CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale ESERCITAZIONE N 4 bis Stati di ossidazione del manganese Il manganese è un tipico elemento di transizione del blocco d.
CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale ESERCITAZIONE N 4 bis Stati di ossidazione del manganese Il manganese è un tipico elemento di transizione del blocco d.
1017 Azoaccoppiamento del cloruro di benzendiazonio con 2-naftolo per formare l 1-fenilazo-2-naftolo
 1017 Azoaccoppiamento del cloruro di benzendiazonio con 2-naftolo per formare l 1-fenilazo-2-naftolo H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5
1017 Azoaccoppiamento del cloruro di benzendiazonio con 2-naftolo per formare l 1-fenilazo-2-naftolo H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5
A) Preparazione di una soluzione di NaOH 0.05 M
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2016/17 Laurea triennale in Preparazione e standardizzazione di una soluzione di Esercitazione n 2 NaOH 0.05 M. Determinazione della concentrazione di
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2016/17 Laurea triennale in Preparazione e standardizzazione di una soluzione di Esercitazione n 2 NaOH 0.05 M. Determinazione della concentrazione di
ALOGENURI (Cl -, Br -, I - ) 1
 ALOGENURI (Cl -, Br -, I - ) 1 Cloruri, bromuri e ioduri di tutti i metalli, eccetto quelli di Pb +,Ag + e Hg + (I), sono solubili in H O. Cloruri, bromuri e ioduri di Pb +,Ag + e Hg + (I) sono inoltre
ALOGENURI (Cl -, Br -, I - ) 1 Cloruri, bromuri e ioduri di tutti i metalli, eccetto quelli di Pb +,Ag + e Hg + (I), sono solubili in H O. Cloruri, bromuri e ioduri di Pb +,Ag + e Hg + (I) sono inoltre
Determinazione percentuale di CaCO3 in un guscio d uovo.
 Determinazione percentuale di CaCO3 in un guscio d uovo. Il CaCO3 presente nel guscio d uovo reagisce con l acido cloridrico secondo la seguente reazione chimica: CaCO3 + 2HCl CaCl2 + H2CO3 Carbonato di
Determinazione percentuale di CaCO3 in un guscio d uovo. Il CaCO3 presente nel guscio d uovo reagisce con l acido cloridrico secondo la seguente reazione chimica: CaCO3 + 2HCl CaCl2 + H2CO3 Carbonato di
ESTRAZIONE CO. Scopo. Strumenti e sostanze. Principi teorici. Metodica. Calcoli. Malboro gold
 ESTRAZIONE CO Scopo Determinare i milligrammi di CO all interno di una sigaretta Strumenti e sostanze STRUMENTI: Becher, buretta, beuta, pipetta, matraccio, cappa, bilancia, bacchetta di vetro, ragno.
ESTRAZIONE CO Scopo Determinare i milligrammi di CO all interno di una sigaretta Strumenti e sostanze STRUMENTI: Becher, buretta, beuta, pipetta, matraccio, cappa, bilancia, bacchetta di vetro, ragno.
DETERMINAZIONI. Acido Citrico. Ka 1 = 4, Ka 2 = 4, Ka 3 = 8,0 10-6
 DETERMINAZIONI Acido Citrico Acido organico tricarbossilico, con costanti acide vicine tra loro; quindi non è possibile dosare i tre protoni separatamente, ma vengono COOH OH COOH COOH PM 192,1 Ka 1 =
DETERMINAZIONI Acido Citrico Acido organico tricarbossilico, con costanti acide vicine tra loro; quindi non è possibile dosare i tre protoni separatamente, ma vengono COOH OH COOH COOH PM 192,1 Ka 1 =
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa
 Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
cognome e nome turno banco data Indicare i CALCOLI per ESTESO Nei RIQUADRI TRATTEGGIATI riportare i dati con le CIFRE SIGNIFICATIVE appropriate
 PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
RICERCA DEGLI ANIONI
 RICERCA DEGLI ANIONI RICERCA DEGLI ANIONI SOSTANZA INIZIALE via secca via umida (soluzione alcalina) Ricerca: ACETATI CARBONATI TARTRATI SOLFITI SOLUZIONE Limpida Incolore RESIDUO Si scarta Ricerca: CLORURI
RICERCA DEGLI ANIONI RICERCA DEGLI ANIONI SOSTANZA INIZIALE via secca via umida (soluzione alcalina) Ricerca: ACETATI CARBONATI TARTRATI SOLFITI SOLUZIONE Limpida Incolore RESIDUO Si scarta Ricerca: CLORURI
2.1 Iodimetria-iodometria
 .1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
.1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico.
 Esperienza n. 5 Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico. una provetta da saggio, porta provette, spruzzetta
Esperienza n. 5 Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico. una provetta da saggio, porta provette, spruzzetta
IV Gruppo: H 2 S 2 H + + S = I solfuri insolubili nelle predette condizioni sono: ZnS. CoS. bianco. nero. MnS. rosa-salmone. nero.
 IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999
 COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
3016 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico
 6 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.)
6 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.)
Sintesi dell acetanilide
 Sintesi dell acetanilide N 2 Cl N + + C 3 benzenammina anidride etanoica N - fenilacetammide acido etanoico (anilina) (anidride acetica) (acetanilide) (acido acetico) d = 1,02 g/ml d = 1,08 g/ml PM = 135
Sintesi dell acetanilide N 2 Cl N + + C 3 benzenammina anidride etanoica N - fenilacetammide acido etanoico (anilina) (anidride acetica) (acetanilide) (acido acetico) d = 1,02 g/ml d = 1,08 g/ml PM = 135
TRACCE DELLA PROVA PRATICA. Estratto del Verbale n. 4 del 19 gennaio 2018 TRACCIA 1
 CONCORSO PUBBLICO PER TITOLI ED ESAMI PER LA COPERTURA DI N. 1 (UNO) POSTO DI CATEGORIA D POSIZIONE ECONOMICA D1, DELL AREA TECNICA, TECNICO SCIENTIFICA ED ELABORAZIONE DATI, CON CONTRATTO DI LAVORO SUBORDINATO
CONCORSO PUBBLICO PER TITOLI ED ESAMI PER LA COPERTURA DI N. 1 (UNO) POSTO DI CATEGORIA D POSIZIONE ECONOMICA D1, DELL AREA TECNICA, TECNICO SCIENTIFICA ED ELABORAZIONE DATI, CON CONTRATTO DI LAVORO SUBORDINATO
Fe(OH) 3. Mn(OH) 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
Fe(OH) 3. Mn(OH) 2. bianco. MnO 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
LABORATORIO DI CHIMICA ANALITICA I ESERCITAZIONI AA
 LABORATORIO DI CHIMICA ANALITICA I ESERCITAZIONI 1-2-3-4-5 AA 2016-2017 ph Esercitazione 1: TITOLO DEL HCl CON CARBONATO SODICO Introduzione CO 3 2- + 2H + = H 2 O + CO 2 Carbonato 0,1 M + HCl 0,1000 M
LABORATORIO DI CHIMICA ANALITICA I ESERCITAZIONI 1-2-3-4-5 AA 2016-2017 ph Esercitazione 1: TITOLO DEL HCl CON CARBONATO SODICO Introduzione CO 3 2- + 2H + = H 2 O + CO 2 Carbonato 0,1 M + HCl 0,1000 M
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
RICERCA DELLA FUNZIONE CARBOSSILICA
 RICERCA DELLA FUNZIONE CARBOSSILICA IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ACIDI ALCUNI IMPORTANTI ACIDI NUMERO DI OSSIDAZIONE Preparazione degli Acidi Carbossilici Riconoscimento
RICERCA DELLA FUNZIONE CARBOSSILICA IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ACIDI ALCUNI IMPORTANTI ACIDI NUMERO DI OSSIDAZIONE Preparazione degli Acidi Carbossilici Riconoscimento
PROGETTO FUMO (DETERMINAZIONE CO)
 PROGETTO FUMO (DETERMINAZIONE CO) I fumatori, quando comprano il loro pacchetto di sigarette quotidiano, di solito non fanno neanche caso alla quantità di monossido di carbonio (d' ora in poi lo chiameremo
PROGETTO FUMO (DETERMINAZIONE CO) I fumatori, quando comprano il loro pacchetto di sigarette quotidiano, di solito non fanno neanche caso alla quantità di monossido di carbonio (d' ora in poi lo chiameremo
TITOLAZIONI TITOLAZIONI ACIDO-BASE
 TITOLAZIONI TITOLAZIONI ACIDO-BASE titolazione nella quale sono coinvolti un acido e una base. La reazione generica è la seguente: Ac1 + Bas2 Ac2 + Bas1 con produzione della base e dell acido coniugato.
TITOLAZIONI TITOLAZIONI ACIDO-BASE titolazione nella quale sono coinvolti un acido e una base. La reazione generica è la seguente: Ac1 + Bas2 Ac2 + Bas1 con produzione della base e dell acido coniugato.
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
LABORATORIO ANALISI DEI FARMACI 1 A.A. 2013/2014
 CORSO DI LAUREA IN CTF LABORATORIO ANALISI DEI FARMACI 1 A.A. 2013/2014 PROF.ssa GIANNA ALLEGRONE Ogni studente dovrà descrivere sul proprio quaderno di laboratorio le esperienze non appena vengono eseguite
CORSO DI LAUREA IN CTF LABORATORIO ANALISI DEI FARMACI 1 A.A. 2013/2014 PROF.ssa GIANNA ALLEGRONE Ogni studente dovrà descrivere sul proprio quaderno di laboratorio le esperienze non appena vengono eseguite
+ NO 2 + 3H 2 O = Ce +3 + NO 3 + 2H 3 O +, b) 0.478 g
 1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
Reazioni analitiche dello ione alluminio L ammoniaca in soluzione acquosa provoca la precipitazione dell idrossido Al(OH) 3 bianco gelatinoso.
 Reazioni analitiche dello ione alluminio L ammoniaca in soluzione acquosa provoca la precipitazione dell idrossido Al(OH) bianco gelatinoso. Al NHOH Al(OH) NH L idrossido precipitato è quasi insolubile
Reazioni analitiche dello ione alluminio L ammoniaca in soluzione acquosa provoca la precipitazione dell idrossido Al(OH) bianco gelatinoso. Al NHOH Al(OH) NH L idrossido precipitato è quasi insolubile
TITOLAZIONI PER PRECIPITAZIONE
 PRECIPITOMETRIA TITOLAZIONI PER PRECIPITAZIONE Le titolazioni per precipitazione sono un alternativa alle analisi gravimetriche (non trattate in questo insegnamento) che, nonostante l accuratezza possono
PRECIPITOMETRIA TITOLAZIONI PER PRECIPITAZIONE Le titolazioni per precipitazione sono un alternativa alle analisi gravimetriche (non trattate in questo insegnamento) che, nonostante l accuratezza possono
LABORATORIO DI ANALISI TECNICHE E STRUMENTALI
 XVII edizione PROVA PRATICA organizzazione: ubicazione: LABORATORIO DI ANALISI TECNICHE E STRUMENTALI Genova, 11 maggio 2018 Regolamento della Gara Nazionale di Chimica La gara è costituita da: a) una
XVII edizione PROVA PRATICA organizzazione: ubicazione: LABORATORIO DI ANALISI TECNICHE E STRUMENTALI Genova, 11 maggio 2018 Regolamento della Gara Nazionale di Chimica La gara è costituita da: a) una
Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI.
 Corso di Laboratorio di Chimica Generale Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI. REAZIONI IN SOLUZIONE 1 Alcuni tipi di reazioni ioniche, che non implichino processi
Corso di Laboratorio di Chimica Generale Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI. REAZIONI IN SOLUZIONE 1 Alcuni tipi di reazioni ioniche, che non implichino processi
RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO
 RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO Prof. Antonio Lavecchia Ricerca dei Cationi nelle Sostanze Inorganiche
RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO Prof. Antonio Lavecchia Ricerca dei Cationi nelle Sostanze Inorganiche
La nozione di ph. SCOPO Valutazione della forza acida
 La nozione di ph PRINCIPIO Il ph è la misura dell attività idrogenionica in relazione agli acidi disciolti in un vino o in un mosto. Il ph si definisce come il logaritmo negativo della concentrazione idrogenionica.
La nozione di ph PRINCIPIO Il ph è la misura dell attività idrogenionica in relazione agli acidi disciolti in un vino o in un mosto. Il ph si definisce come il logaritmo negativo della concentrazione idrogenionica.
LEZIONE 5 TITOLO DELLE SOLUZIONI E TITOLAZIONE ACIDO BASE
 http://www. LEZIONE 5 TITOLO DELLE SOLUZIONI E TITOLAZIONE ACIDO BASE TITOLO DELLE SOLUZIONI E TITOLAZIONE ACIDO BASE Il titolo di una soluzione non è altro che la sua concentrazione; dire che una soluzione
http://www. LEZIONE 5 TITOLO DELLE SOLUZIONI E TITOLAZIONE ACIDO BASE TITOLO DELLE SOLUZIONI E TITOLAZIONE ACIDO BASE Il titolo di una soluzione non è altro che la sua concentrazione; dire che una soluzione
Reazioni analitiche dello ione acetato
 Reazioni analitiche dello ione acetato Gli acetati trattati con acidi più forti dell acido acetico formano acido acetico, un liquido incolore, volatile che odora di aceto. Il composto generalmente utilizzato
Reazioni analitiche dello ione acetato Gli acetati trattati con acidi più forti dell acido acetico formano acido acetico, un liquido incolore, volatile che odora di aceto. Il composto generalmente utilizzato
Curve di Titolazione, indicatori
 Curve di Titolazione, indicatori 1 Attrezzature a: pipetta b: buretta c: sostegno d: beuta e: agitatore b a a f: spruzzetta c f H 2 O piano di lettura d e 2 2 Attrezzature a b i a: beaker b: beuta c: beuta
Curve di Titolazione, indicatori 1 Attrezzature a: pipetta b: buretta c: sostegno d: beuta e: agitatore b a a f: spruzzetta c f H 2 O piano di lettura d e 2 2 Attrezzature a b i a: beaker b: beuta c: beuta
Acido 3,5-dinitrosalicilico Glucosio Acido 3-amino-5-nitrosalicilico Acido gluconico (Incolore-giallo leggero)
 1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione (Corso di Fisiologia della produzione e della post-raccolta) In banana durante il processo di maturazione
1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione (Corso di Fisiologia della produzione e della post-raccolta) In banana durante il processo di maturazione
Esercitazione 6. Chimica biologica del Fe. Il Ferro ) 2 (SO 4 6H 2. Fe(NH 4
 Esercitazione Preparazione del sale di Mohr Fe(NH 4 ) 2 (SO 4 ) 2 H 2 O Chimica biologica del Fe In un uomo di 75 kg sono presenti 4 g di Fe Nei Paesi occidentali ne assumiamo 15 mg/d Il Ferro Configurazione
Esercitazione Preparazione del sale di Mohr Fe(NH 4 ) 2 (SO 4 ) 2 H 2 O Chimica biologica del Fe In un uomo di 75 kg sono presenti 4 g di Fe Nei Paesi occidentali ne assumiamo 15 mg/d Il Ferro Configurazione
XVII ZOLFO. Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE. Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI
 XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
Esperienza n 1 PREPARAZIONE DI SOLUZIONI A VARIA CONCENTRAZIONE PER PESATA E PER DILUIZIONE ESPERIENZE DI ANALISI QUALITATIVA DI VARIE SPECIE CHIMICHE
 Esperienza n 1 PREPARAZIONE DI SOLUZIONI A VARIA CONCENTRAZIONE PER PESATA E PER DILUIZIONE ESPERIENZE DI ANALISI QUALITATIVA DI VARIE SPECIE CHIMICHE PRIMA PARTE: preparazione di soluzioni a varia concentrazione
Esperienza n 1 PREPARAZIONE DI SOLUZIONI A VARIA CONCENTRAZIONE PER PESATA E PER DILUIZIONE ESPERIENZE DI ANALISI QUALITATIVA DI VARIE SPECIE CHIMICHE PRIMA PARTE: preparazione di soluzioni a varia concentrazione
ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICA VI EDIZIONE
 Alunno n campione... n campione extra... GARA NAZIONALE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICA VI EDIZIONE LUIGI DELL ERBA CASTELLANA GROTTE (BA) 5 6 dicembre 2007 [...] distillare è bello. Prima
Alunno n campione... n campione extra... GARA NAZIONALE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICA VI EDIZIONE LUIGI DELL ERBA CASTELLANA GROTTE (BA) 5 6 dicembre 2007 [...] distillare è bello. Prima
SAGGI PER VIA SECCA. Fiamma Ossidante. Fiamma Riducente C C
 SAGGI PER VIA SECCA Fiamma Ossidante 1350-1500 C Fiamma Riducente 400-500 C Ricerca dei Cationi per Via Secca Gli elementi metallici presenti nei composti organometallici della F.U. sono: Sodio, Potassio,
SAGGI PER VIA SECCA Fiamma Ossidante 1350-1500 C Fiamma Riducente 400-500 C Ricerca dei Cationi per Via Secca Gli elementi metallici presenti nei composti organometallici della F.U. sono: Sodio, Potassio,
FLUIDO MAGNETICO Sintesi del Ferrofluido
 Università degli Studi di Genova Dipartimento di chimica e chimica industriale Progetto Lauree Scientifiche Laboratori Regionali 2009-2010 Scienza dei Materiali FLUIDO MAGNETICO Sintesi del Ferrofluido
Università degli Studi di Genova Dipartimento di chimica e chimica industriale Progetto Lauree Scientifiche Laboratori Regionali 2009-2010 Scienza dei Materiali FLUIDO MAGNETICO Sintesi del Ferrofluido
Determinazione dell ACIDITA dell OLIO D 0LIVA
 LABORATORIO INDUSTRIE AGRARIE Istituto d Istruzione Superiore G.Cantoni Treviglio (Bergamo) Unità Didattica: Determinazione dell ACIDITA dell OLIO D 0LIVA a.s. 2011-2012 L acidità è un parametro che indica
LABORATORIO INDUSTRIE AGRARIE Istituto d Istruzione Superiore G.Cantoni Treviglio (Bergamo) Unità Didattica: Determinazione dell ACIDITA dell OLIO D 0LIVA a.s. 2011-2012 L acidità è un parametro che indica
3011 Sintesi dell acido eritro-9,10-diidrossistearico dall acido oleico
 311 Sintesi dell acido eritro-9,1-diidrossistearico dall acido oleico COOH KMnO 4 HO COOH NaOH HO C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Riferimento in letteratura: Lapworth,
311 Sintesi dell acido eritro-9,1-diidrossistearico dall acido oleico COOH KMnO 4 HO COOH NaOH HO C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Riferimento in letteratura: Lapworth,
PROVA PRATICA GARA NAZIONALE DI CHIMICA
 Via Luosi n. 23 41124 Modena Tel: 059211092 059236398 Fax: 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it GARA NAZIONALE DI CHIMICA XII EDIZIONE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICO
Via Luosi n. 23 41124 Modena Tel: 059211092 059236398 Fax: 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it GARA NAZIONALE DI CHIMICA XII EDIZIONE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICO
RISOLUZIONE ENO 25/2004
 DICARBONATO DI DIMETILE (DMDC) L'ASSEMBLEA GENERALE, Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce l'organizzazione internazionale della vigna e del vino Su proposta della
DICARBONATO DI DIMETILE (DMDC) L'ASSEMBLEA GENERALE, Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce l'organizzazione internazionale della vigna e del vino Su proposta della
QUARTA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 QUARTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quarta Esperienza di Laboratorio Prove di solubilità Riconoscimento della funzione carbonilica Formazione di 2,4-dinitrofenilidrazoni (reazione
QUARTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quarta Esperienza di Laboratorio Prove di solubilità Riconoscimento della funzione carbonilica Formazione di 2,4-dinitrofenilidrazoni (reazione
IV Gruppo: I solfuri insolubili nelle predette condizioni sono: ZnS. CoS. bianco. nero. MnS. nero. rosa-salmone. NiS
 IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
