Acqua, elettroliti ed equilibrio acido-base
|
|
|
- Simone Bonelli
- 8 anni fa
- Visualizzazioni
Transcript
1 Acqua, elettroliti ed equilibrio acido-base
2 L adattamento dei mammiferi alla vita terrestre ha comportato lo sviluppo di complessi meccanismi fisiologici di controllo dell omeostasi che includono diversi sistemi tampone e di regolazione dell acqua, degli elettroliti e del ph a livello intracellulare ed extracellulare. L acqua svolge un ruolo essenziale nel mantenimento di tale omeostasi: attraverso il trasporto di sostanze nutritive, elettroliti ed ossigeno alle cellule; attraverso l escrezione di cataboliti; attraverso la regolazione della temperatura corporea.
3 Il mantenimento dell omeostasi dell acqua è fondamentale per la sopravvivenza di tutti gli organismi. Nei mammiferi la preservazione della costanza della PRESSIONE OSMOTICA e della distribuzione dell acqua nei diversi compartimenti corporei è intimamente associata alla regolazione di SODIO, POTASSIO, CLORURO e BICARBONATO
4 Distribuzione dell acqua nell organismo Uomo 70 kg: in media possiede 42 litri di acqua (60-70% del peso corporeo) ECF (interstizio) ECF (plasma) ECF (CSF, urina etc) ICF Acqua nel corpo umano: 2/3 (28 L)nel ICF (liquido intracell. LIC) 1/3 (14 L)nel ECF (liquido extracell. LEC) ECF: 10 L liquido interstiziale 3 L plasma 1.2 L liquidi transcellulari (urina, feci, liquido cefalo-rachidiano, liquido pleurico ecc.)
5
6 Distribuzione degli elettroliti nell organismo Il sodio (Na + ) è il principale catione extracellulare; Il potassio (K + ) è il principale catione intracellulare; I principali anioni extracellulari sono il cloruro (Cl - ) e bicarbonato (HCO 3- ) I principali anioni intracellulari sono le proteine e il fosfato; Presenti in forma libera Gli anioni non misurabili direttamente costituiscono l anion gap (fosfato, solfato, proteine, acidi organici) PROFILO ELETTROLITICO [Na + ] + [K + ] = [Cl - ] + [HCO 3- ] + [gap anionico]
7 Diffusione, Osmosi e Pressione Osmotica Il comportamento delle molecole di solvente e di soluto in una soluzione danno luogo a fenomeni molto importanti nei sistemi biologici, quali la diffusione e l osmosi. Questi fenomeni manifestano la loro importanza ogni volta che ci si trova di fronte a due diversi compartimenti che devono, o non devono, consentire il passaggio di soluti da un compartimento all altro. I nutrienti trasportati dal sangue devono poter entrare nelle cellule, ma il contenuto delle cellule (proteine, DNA e altro) non devono poter uscire, mentre vanno allontanate da esse prodotti di rifiuto: ma cosa regola questo passaggio? In più, abbiamo specie ioniche dalle ben precise diverso concentrazioni tra i vari compartimenti cellulari..approfondiamo!!!!!
8 Quando la membrana separa due compartimenti contenenti soluzioni a differente concentrazione, può comportarsi in vari modi a cui corrispondono nomi differenti: 1. Membrana permeabile o setto poroso: questa membrana rallenta solo il mescolamento delle soluzioni che separa, ma è permeabile sia al soluto (o soluti) che al solvente 2. Membrana semipermeabile: lascia passare solo il solvente e non i soluti 3. Membrana selettivamente permeabile, (o Semipermeabile reale): lascia passare solo il solvente ed alcuni soluti mentre è impermeabile per la maggior parte di questi ultimi Membrane cellulari
9 Quando due soluzioni con composizione diversa sono separate da una membrana permeabile, soluti e solvente la possono attraversare liberamente ed abbiamo il fenomeno della Diffusione; se invece la membrana è semipermeabile, i soluti non la possono attraversare ed abbiamo il fenomeno dell Osmosi
10 Le membrane biologiche sono selettivamente permeabili Più una molecola è piccola e solubile nei lipidi e più facilmente attraversa la membrana Piccole molecole idrofobiche Piccole molecole polari neutre O 2, CO 2 N 2 Benzene H 2 O Glicerolo Etanolo Molecole grosse e polari non diffondono attraverso la membrana Grosse molecole polari neutre Ioni Amminoacidi Glucosio Nucleotidi H +, Na +, HCO 3 - K +, Ca 2+, Cl -, Mg 2+
11
12 Le proprietà colligative o correlate delle soluzioni sono: Abbassamento della Pressione di Vapore (o Tensione di Vapore) Abbassamento crioscopico Innalzamento Ebullioscopico Pressione Osmotica
13 L OSMOSI è il processo attraverso il quale molecole di solvente liquido passano attraverso una membrana con fori di dimensioni tali da impedire il passaggio del soluto La PRESSIONE OSMOTICA è la pressione π che si deve esercitare per raggiungere l equilibrio osmotico (cioè per FERMARE il flusso di solvente)
14 membrana semipermeabile (fa passare solo il solvente) solvente con soluto A B solvente puro flusso di solvente (osmosi) Pressione osmotica = pressione che occorre esercitare su A per bloccare il flusso osmotico
15 PRESSIONE OSMOTICA SOLVENTE SOLUZIONE P idrostatica
16 La pressione osmotica, intesa come la pressione che si deve applicare per impedire la diluizione del soluto, viene misurata quantitativamente con la relazione di Van't Hoff: π = pressione osmotica π V = n R T i da cui: π = R T (n i)/v = R T Osm/V dove: R = costante dei gas = [l][atm][mol] -1 [K] -1 ; T = temperatura assoluta in K; V = volume (L) Osm = osmoli, ovvero moli di particelle osmoticamente attive; i = fattore di correzione che tiene conto del numero di molecole in soluzione (derivanti dalla eventuale dissociazione del soluto);
17 In questo caso, la concentrazione Osmol/L rappresenta la concentrazione totale di tutte le particelle che non possono attraversare la membrana. Questa concentrazione Osmol/L (che è uguale a M i) prende il nome di OSMOLARITÀ della soluzione. Oltre all osmolarità, viene usata anche l'osmolalità, che è sempre una misura della concentrazione di una soluzione e rappresenta il numero di osmoli di soluto per chilogrammo di solvente; essa è una grandezza più precisa dell osmolarità perché non risente della temperatura ambientale e della natura della soluzione. Nel caso dell'osmolalità il numero di molecole di soluto in rapporto con quelle di solvente è costante, nell'osmolarità è variabile ma a temperatura e pressioni costanti le differenze sono normalmente trascurabili e i due termini sono usati indifferentemente!
18 Riassumiamo: Osmolalità = numero di molecole disciolte in 1Kg di solvente. È una misura della concentrazione di una soluzione, sottolineando il numero di particelle disciolte in un liquido, indipendentemente dalla carica e dalle dimensioni: una soluzione 1 Osm contiene il numero di particelle di una mole di sostanza non dissociabile disciolta in 1 Kg di acqua distillata. Indipendente dalla t. Preferibile nei sistemi biologici, per le soluzioni fisiologiche si esprime in mosm/kg H 2 O. Osmolarità (Osm/L) = pressione osmotica generata dalle molecole di soluto disciolte in 1L di solvente. Dipende dalla temperatura che modifica il volume ( t V). Per soluzioni molto diluite - come quelle corporee - le differenze quantitative tra osmolarità ed osmolalità sono al di sotto dell'1% (perché solo una piccola parte del loro peso deriva dal soluto). Per questo i due termini sono spesso usati indifferentemente come sinonimi
19 Osmolarità dei fluidi biologici Sia la membrana capillare che quasi tutte le membrane cellulari sono liberamente permeabili all acqua, ma sono permeabili solo ad alcuni soluti. I soluti che non possono entrare liberamente nelle membrane dei compartimenti vengono chiamati sostanze osmolari effettive mentre quelle che possono attraversare liberamente la membrana cellulare vengono chiamate non effettive. Le sostanze osmolari effettive determinano la distribuzione dell acqua tra i compartimenti. Un qualsiasi cambiamento nella concentrazione di soluti osmoticamente attivi su di un lato della membrana crea un gradiente osmotico: ne consegue che l acqua verrà ridistribuita tra i compartimenti finché sarà nuovamente raggiunta la medesima osmolarità (isosmolarità) tra i compartimenti. (Nelle soluzioni diluite, come i fluidi corporei, dove il volume occupato dai soluti è piccolo, si preferisce calcolare la concentrazione delle particelle in termini di osmolarità)
20
21 La composizione dei compartimenti liquidi regola gli scambi di acqua e soluti
22 La pressione osmotica del plasma è dunque: P = 0.30 [osmol/l] [atm l/mol K] ( )[K] = 7.6 atm La P oncotica del plasma (~20 mmhg), determinata dalle proteine che non diffondono attraverso la parete capillare, è solo un duecentesimo della totale, ma è fondamentale per gli scambi con l interstizio.
23 CONTRIBUTI ALLA PRESSIONE ONCOTICA TOTALE NEL PLASMA Proteina PM kda Conc g/l P oncotica mmhg Albumina Globuline Fibrinogeno Totale
24 L osmolalità dei liquidi biologici (siero o urine) è comunemente misurata in laboratorio mediante osmometri che valutano le variazioni delle proprietà colligative di una soluzione, oppure può essere calcolata.
25 L'Osmometro è uno strumento utilizzato per la determinazione dell'osmolalità di liquidi biologici e soluzioni tramite la misura del punto crioscopico o temperatura di congelamento. La temperatura viene misurata da un termistore incorporato nella testata dello strumento che viene introdotto nella cuvetta contenente il campione all'inizio della misura. Nella prima fase dell'analisi abbiamo una veloce riduzione della temperatura del campione mentre nella seconda fase abbiamo il raggiungimento del punto di congelamento, quest'ultimo indotto da ultrasuoni. La misura termina quando la temperatura di congelamento del campione rimane stabile (Plateau). Principio di funzionamento: Il punto di congelamento di acqua pura è esattamente C a pressione atmosferica. Una mole di una sostanza non-dissociata, per esempio glucosio, sciolto in 1 kg di acqua pura, abbassa il punto di congelamento di C. La misura del punto crioscopico consiste nella refrigerazione di un campione e nell'innesco ad ultrasuono. Il campione entra una fase di coesistenza di ghiaccio e acqua (plateau) dove la temperatura è stabile. L'osmometro misura in modo molto preciso la temperatura del campione.
26 Osmolalitàplasmatica(mmoli/kg):1,863 x glicemia(mg/dl) Na(mmol/l) 18 urea(mg/dl) 2,8 Per il calcolo dell osmolalità è possibile usare questa formula. Si noti che, nella formula, il sodio si moltiplica x 2, perché l effetto osmotico esercitato da una mole di cloruro di sodio è doppio (2 osmoli), in quanto sodio e cloro si dissociano. Il glucosio viene diviso per 18 e l azoto ureico per 2,8 per convertire i valori da mg/decilitro a meq/litro; infatti, il peso molecolare del glucosio è 180 e il peso atomico dell azoto è 28 e, come è noto, la conversione in meq/litro utilizza la seguente formula: meq/litro = (mg/litro) Valenza/Peso atomico. Dal momento che i valori di glucosio e azoto ureico vengono di norma forniti in mg/decilitro, il loro impiego nella formula in mg/litro richiede che entrambi vengano divisi per 10. Alla necessità di questa conversione si deve il fatto che il peso molecolare del glucosio venga espresso nella formula come 18 (e non 180) e quello atomico dell azoto ureico come 2,8 (e non 28). Applicando la formula riportata, l osmolalità del LEC risulta essere pari a 290 mosm/kg H 2 O. Il parametro calcolato STIMA l osmolalità, ma non ne riflette il reale valore globale, in quanto non considera le eventuali altre sostanze attive presenti in soluzione (oltre a sodio, glucosio e urea) GAP OSMOLALE
27 Riassumendo: L acqua si muove rapidamente tra i diversi compartimenti liquidi dell organismo. Il movimento di acqua attraverso le membrane cellulari dipende dalla differenza di osmolalità tra LIC e LEC. Data la grande permeabilità delle membrane cellulari all acqua, variazioni di osmolalità del LEC o del LIC, comportano rapido movimento di acqua tra i due compartimenti che, con l eccezione di brevi periodi transitori, permette l equilibrio osmotico tra LEC e LIC.
28 Mantenimento dell equilibrio osmotico tra LEC e LIC Osmolalità di ciascun compartimento ~280 mosm/kg H 2 O Nel LEC (liquido interstiziale e plasma), l osmolalità è determinata per il 90% da ioni Na + Cl - e HCO 3 Nel LIC l osmolalità è determinata per il 50% da ioni K + e per il resto da altre sostanze presenti nelle cellule
29 Ripasso di qualche concetto.. PRESSIONE OSMOTICA DEI LIQUIDI BIOLOGICI: SOLUZIONI ISOTONICHE. Una soluzione che ha la stessa pressione osmotica totale del sangue si definisce isotonica. Sono esempi di soluzioni isotoniche la soluzione di NaCl allo 0,9% peso/volume (soluzione fisiologica) o quella di glucosio al 5% peso/volume (soluzione glucosata); entrambe hanno concentrazione pari a 0,28-0,30 OsM e π = 7,6 atm a 37. Soluzioni a concentrazione maggiore sono definite ipertoniche, a concentrazione minore ipotoniche. Soltanto soluzioni isotoniche o molto prossime all'isotonicita' possono essere impiegate per l'infusione endovenosa: infatti le cellule ematiche confrontate con soluzioni ipotoniche si rigonfiano d'acqua fino a scoppiare (flusso osmotico dall'esterno verso l'interno della cellula); confrontate con soluzioni ipertoniche perdono acqua, si raggrinziscono e diventano non funzionali (questo danno e' in genere reversibile).
30
31 Tutti gli scambi di acqua con l ambiente esterno (infusione endovenosa, assunzione e perdita attraverso l apparato gastroenterico) avvengono attraverso il LEC. L introduzione di soluzioni iso-, ipo- o iper-osmotiche comporta solo variazioni di volume del LIC e del LEC, perché l eventuale differenza di osmolalità tra LIC e LEC viene bilanciata rapidamente dal movimento di acqua, (la membrana cellulare è molto permeabile all acqua e quasi totalmente impermeabile a molti soluti). Le variazioni di volume del LIC sono sempre secondarie a movimenti di acqua: LIC LEC o LEC LIC, che si verificano solo in seguito a modificazioni di osmolalità del LEC.
32 I meccanismi atti a mantenere l omeostasi dell acqua originano nell ipotalamo: in presenza di aumenti dell osmolarità, in primo luogo viene indotta la sensazione della sete, che induce un maggior consumo di acqua ed una relativa espansione dei fluidi extracellulari, con conseguente diluizione delle sostanze ad attività osmotica. Secondariamente, l ipotalamo induce la secrezione di ormone antidiuretico (AVP o ADH) da parte dell ipofisi posteriore, che a sua volta stimola il riassorbimento di acqua da parte delle cellule dei dotti collettori renali, con conseguente riduzione dell osmolarità plasmatica (e produzione di urine concentrate).
33 ADH (ormone antidiuretico), o AVP E un peptide (9 aa) sintetizzato dall ipotalamo ed immagazzinato nell ipofisi posteriore, da cui viene rilasciato; un osmolalità plasmatica aumentata (anche solo del 2%, con riduzione della velocità del flusso urinario fino a 0,5 ml/min) stimola gli osmorecettori dell ipotalamo a produrre ADH, che viene rilasciato verso il rene e che favorisce il riassorbimento dell acqua nei reni (le cellule dei dotti collettori distali dei reni, normalmente impermeabili all acqua, divengono permeabili); con osmolalità diminuita, avvengono eventi opposti Aumento osmolalità plasmatica Diminuzione osmolalità plasmatica
34 Uno squilibrio tra quantità di acqua e Na + nel fluido extracellulare porta a variazioni di osmolalità e il movimento di acqua che ne consegue determina la contrazione o l espansione del volume cellulare ed è causa di alcuni disordini clinici L escrezione di acqua dal rene è controllata dalla vasopressina (AVP) o ADH (ormone antidiuretico), visto prima, mentre i livelli di sodio sono regolati dal sistema renina-angiotensina, che a sua volta regola la secrezione di aldosterone, e da un terzo fattore, il peptide atriale natriuretico
35 SODIO Valori normali nell ECF : mmoli/l Assunzione variabile: 120mmoli - 300mmoli/die (4-6 g al giorno) In una persona sana, il sodio totale corporeo non cambia, anche se l assunzione diminuisce fino a 5 mmoli o aumenta fino a 750 mmoli Perdite: urine sudorazione gastrointestinale (nei malati) L escrezione di Na + urinario è regolata da: aldosterone peptide natriuretico (ANP)
36 Funzioni del Sodio Regola l'osmolarità del plasma e del liquido extracellulare: se presente in concentrazioni eccessive, richiama, per ragioni di osmosi, notevoli quantità di acqua, causando edema ed ipertensione (a causa dell'aumento di volume ematico); al contrario, in presenza di deficit di sodio, si assiste ad una diminuzione del volume di sangue e di liquido interstiziale. Forma gradienti elettrochimici a livello della membrana cellulare, che sono molto importanti per la trasmissione dell'impulso nervoso, per la contrazione muscolare e per gli scambi cellulari (nutrienti, ioni, acqua ecc.). Regola l equilibrio acido-base
37 Il sodio è completamente filtrato dai glomeruli Una frazione variabile fra il 70 e l 80% del sodio presente nella preurina è RIASSORBITA dal tubulo contorto prossimale, insieme ad acqua e cloruro Una frazione del 20-25% è riassorbita a livello dell ansa di Henle ascendente A livello del tubulo contorto distale viene riassorbito il rimanente 5-10% del sodio filtrato. A questo livello il meccanismo di riassorbimento è governato dalle pompe Na + /K + e Na + /H +, regolate dall aldosterone. Il riassorbimento distale è la componente maggiormente implicata nel determinare la quantità di sodio escreta nelle urine. Il rene ha una capacità molto ampia di gestire il meccanismo e il grado di concentrazione delle urine, da 50 mosm/l a 1400 mosm/l, a seconda delle necessità
38 Sistema RENINA-ANGIOTENSINA Angiotensinogeno (452 aminoacidi) Renina ACE Angiotensina I (10 aminoacidi) Angiotensin converting enzyme Angiotensina II (8 aminoacidi) vasocostrittore Il ruolo fisiopatologico di tale sistema è quello di mantenere entro limiti normali la pressione del sangue, agendo sul volume plasmatico, sul bilancio salino, sulla pressione di perfusione renale, eventualmente modificandoli ( ma anche: stimola rilascio di catecolamine, norepinefrina e vasopressina) Surrenali Aldosterone
39 ACE inibitori, anti-ipertensivi Benazepril Lisinopril Enalaprilat Captopril Ramipril
40 Aldosterone Ormone steroideo (mineralcorticoide) prodotto nelle surrenali; Diminuisce la secrezione di Na + urinario, aumentandone il riassorbimento nei tubuli renali distali, a spese degli ioni H + e K + Uno stimolo importante alla secrezione di aldosterone è il volume ECF: Un calo di pressione viene avvertito dalle cellule iuxtaglomerulali che secernono renina e viene innescata la sequenza che porta alla secrezione di aldosterone Target: epitelio del dotto collettore renale: attività di Na/K-ATPasi riassorbimento di Na + escrezione di K + e H + Patologie correlate: Iperaldosteronismo (sindrome di Conn): produzione di renina e ipertensione Morbo di Addison: distruzione delle ghiandole surrenali, aldosterone, secrezione renale di K, iperkalemia Tumore delle ghiandole surrenali: aldosterone, secrezione renale di K, ipokalemia
41 RITENZIONE DI ACQUA ESCREZIONE DI ACQUA
42 Peptide natriuretico atriale (ANP, terzo fattore) Ormone polipeptidico prodotto da cellule specializzate dell atrio destro del cuore Viene secreto come conseguenza di un eccessivo aumento della pressione sanguigna. A livello dei reni, fa aumentare l escrezione di sodio urinario per ridurre l'acqua e i carichi adiposi nel sistema circolatorio, abbassando per questo la pressione sanguigna Pro-ANP (126 aminoacidi) ANP (28 aminoacidi) Rene escrezione Na Muscolo liscio contrazione Ipertensione
43 Valutazioni di laboratorio Pressione osmotica: metodo diretto, effettuato mediante osmometri, basato sulla misura dell innalzamento della tensione di vapore o sull abbassamento del punto di congelamento (tecnica crioscopica); Renina-angiotensina: dopo incubazione del plasma a 37 si misura con tecnica RIA l angiotensina I; Aldosterone: si misura con tecnica RIA o con tecnica immunometrica con marcatori non radioattivi; Ormone antidiuretico (ADH): si misura con tecnica RIA o con tecnica immunometrica con marcatori non radioattivi;
44 Sodio: I campioni in cui è possibile dosare il sodio sono siero, plasma eparinato, sangue intero, sudore, urine, feci, liquidi gastroenterici e liquor. L emolisi non induce alterazioni rilevanti nella concentrazione plasmatica di Na + poiché gli eritrociti contengono solo un decimo del Na + presente nel plasma Si usa la fotometria a fiamma o la potenziometria con elettrodi iono-selettivi (ISE) Un siero lipemico può risultare una significativa fonte di errore quando non vengono utilizzati elettrodi ioni-selettivi (pseudoiponatriemia) Intervalli di riferimento Siero: mmol/l Urine: meq/l in 24h Liquor: mmol/l Feci: <10 mmol in 24h
45 Alterazioni del metabolismo idrico e del sodio IPONATRIEMIA (o iposodiemia): La concentrazione di Na + < mmoli/l Cause di iponatriemia: Iponatriemia ipotonica: Iponatremia ipovolemica: causata da assunzione di diuretici, perdita renale di sali, deficit di mineralcorticoidi, diarrea, vomito, ustioni gravi, pancreatite, traumatismi Iponatriemia euvolemica: causata da sindrome da ipersecrezione inappropriata dell'ormone antidiuretico (SIADH), ipotiroidismo, insufficienza surrenalica, polidipsia Iponatriemia ipervolemica: causata da insufficienza cardiaca congestizia, insufficienza epatica, cirrosi, malattie renali
46 Eccezioni alla iposmolarità/iponatriemia: La pseudoiponatremia risulta da un artefatto nel quale la concentrazione di sodio risulta falsamente ridotta dallo spiazzamento della fase acquosa del plasma da parte di lipidi (per es. ipertrigliceridemia severa) o proteine (per es. mieloma multiplo e macroglobulinemia di Waldenström). Questo problema può essere evitato con l utilizzo di un elettrodo selettivo per il sodio, che ne misura la concentrazione direttamente senza essere influenzato da cambiamenti nella proporzione relativa della fase acquosa e non acquosa del plasma. Sul siero intero: con metodi spettrofotometrici ho problemi dalle alte conc. di trigliceridi o proteine, che occupano un certo volume Valutata solo la frazione acquosa Sulla fase acquosa si procede con elettrodi iono-selettivi, che mi danno un risultato univoco in entrambi i casi (campioni normali/campioni iperlipemici) Valutato tutto il siero Valutato tutto il siero
47 Valutazione clinica e trattamento dell iponatriemia Per valori di sodiemia minori di 135 mmol/l, ma superiori a 125 mmol/l (iponatriemia lieve) i sintomi sono leggeri, vaghi, o del tutto assenti (essenzialmente di natura gastrointestinale, specie nausea e vomito). A concentrazioni inferiori di sodio, i sintomi si accentuano: allucinazioni, convulsioni, crampi muscolari, debolezza muscolare, epilessia, secchezza delle fauci, rallentamento dei riflessi, ecc ecc. Nei casi più gravi, l'iponatriemia può indurre coma, depressione respiratoria e morte. Trattamenti: Senza edema (valori normali di urea, creatinina, pressione sanguigna): Riduzione apporto di fluidi Con edema (sovraccarico di acqua e Na + ): Diuretici Riduzione apporto fluidi
48 IPERNATRIEMIA (> 145 mmol/l) Sviluppato o per incremento del sodio o per perdita di acqua (molto meno comune) Trattamento dell ipernatriemia: Ipernatriemia ipovolemica: correzione del deficit di volume mediante somministrazione di soluzioni saline ipotoniche Ipernatriemia ipervolemica: occorre rimuovere il sodio in eccesso tramite diuretici (furosemide) associati a reintegro con liquidi ipotonici;
49 POTASSIO Principale catione intracellulare (98%, 160 mmoli/l) variabile in funzione dell attività metabolica); Concentrazione extracellulare : 2% (4-5 mmol/l)(poco influenzata dall equilibrio idrico) Valori riferimento (siero): mmoli/l Assunzione variabile: 50 mmoli-150 mmoli/die (4-6 g al giorno) Perdite: urine (30-90 mmol/die) feci e sudore (5 mmol/die) Riserve modeste (soggette a rapida deplezione)
50 Funzioni del Potassio Regolazione dell osmolalità e del volume intracellulare; Ruolo nell equilibrio acido-base (spostamento attraverso le membrane cellulari); Cofattore di enzimi in diversi processi metabolici; Regolazione dell eccitabilità delle fibrocellule in generale, e del miocardio e dei muscoli stesse; in particolare, risultando essenziale per la contrazione delle Il potassio extracellulare, pur essendo una piccola frazione del totale, influenza notevolmente la funzione neuromuscolare; Il rapporto tra potassio intracellulare ed extracellulare è il fattore principale nel determinare il potenziale di membrana nei tessuti suscettibili di stimolazione.
51 RENE fulcro dell omeostasi del potassio nell organismo Il potassio filtrato è quasi completamente riassorbito (60-70%) nei segmenti prossimali Il potassio nelle urine deriva quasi interamente dal potassio escreto a livello del tubulo contorto distale e del tubulo collettore, sotto regolazione aldosteronica e scambiato con Na + riassorbito.
52 MECCANISMI RENALI CHE REGOLANO L'ESCREZIONE DI POTASSIO: Concentrazione di potassio nelle cellule tubulari (dieta) L'aumento del K + nelle cellule tubulari distali genera un aumentata secrezione perché queste cellule sono liberamene permeabili a questo ione dal lato tubulare (è come se, per il potassio, fossero bucate : più le riempi, più K + esce); Equilibrio acido-base: Acidosi: iperpotassiemia (IPERKALIEMIA) Alcalosi: ipopotassiemia (IPOKALIEMIA) L escrezione renale di K + è favorita dall'alcalosi MA inibita dall acidosi attraverso variazioni corrispondenti nel K + contenuto nelle cellule tubulari distali dovute all'alterazione dell'equilibrio acido-base (ACIDOSI: URINE ACIDE CON BASSO CONTENUTO DI POTASSIO).
53 Aldosterone L'aldosterone stimola l escrezione tubulare di K +, e l'increzione di aldosterone è stimolata dalla kaliemia: maggiore la concentrazione di potassio plasmatico, maggiore l'increzione di aldosterone (regolazione a feedback negativo) Il rapporto tra potassio plasmatico e potassio intra-cellulare è influenzata da alcuni ormoni: Favoriscono l'ingresso del potassio nelle cellule: aldosterone insulina catecolamine β-adrenergiche Inibiscono la captazione cellulare del potassio agonisti α-adrenergici
54 Dosaggio del Potassio: Le piastrine possono rilasciare potassio durante la formazione del coagulo, dando per il siero risultati da 0,2 a 0,5 mmol/l maggiori rispetto al plasma ed al sangue intero, per cui il plasma è il campione di scelta per il dosaggio del K + Necessario l utilizzo di metodiche che minimizzino l emolisi, in quanto il rilascio di potassio anche solo da parte dello 0,5% degli eritrociti aumenta i valori di potassiemia di 0,5 mmol/l Se utilizzati elettrodi iono-selettivi (ISE) su sangue intero c è rischio di sovrastima della potassiemia in quanto non monitorabile macroscopicamente l emolisi Intervalli di riferimento Siero: 3,5-5 mmol/l Plasma: 3,4 4,8 meq/l in 24h Liquor: 70% dei livelli plasmatici Urine: mmol/l in 24h Feci: 60 mmol in 24h (diarree)
55 Alterazioni del metabolismo del potassio IPERPOTASSIEMIA (o IPERKALIEMIA): La concentrazione di K + >5.2 mmoli/l Cause Ridotta escrezione urinaria: Insufficienza renale, acuta e cronica (quando la velocità di filtrazione glomerulare è molto bassa); Farmaci come antiinfiammatori non steroidei (FANS), beta-bloccanti o spironolattone possono ridurre l escrezione urinaria; ACE-inibitori (angiotensin-converting-enzyme inhibitors), sartani (antagonisti del recettore per l'angiotensina II); anti-aldosteronici Funzione renale normale o lievemente compromessa: Diuretici risparmiatori di potassio possono far aumentare il livello plasmatico di K + (spironolattone, amiloride, triamterene); Deficienza mineralcorticoide (malattia di Addison (ipoaldosteronismo), o con l uso di antagonisti dell aldosterone)
56 Ridistribuzione (fuoriuscita del potassio dai tessuti/cellule): Acidosi (ridistribuzione di K + dal fluido intracellulare a quello extracellulare) Rilascio di K + da cellule danneggiate (versamento di K + intracellulare: tumori, traumi, sindrome da schiacciamento muscolare, emolisi intravascolare, emorragia interna ecc.) Iperosmolarità Deficit di insulina (viene a mancare l'azione dell'insulina che favorisce lo spostamento del potassio verso l'interno delle cellule muscolari); Farmaci (alterando la captazione tissutale di potassio) Eccesso di somministrazione (terapia con dosaggi eccessivi). La gravità dell'iperkaliemia causata da eccessivo apporto di potassio, per via orale o endovenosa, è influenzata da fattori che modulano la captazione tissutale e l'escrezione renale del potassio.
57 PSEUDOIPERPOTASSIEMIA (o iperpotassemia spuria) Prima di interpretare come patologico un elevato valore della potassiemia occorre escludere le cause di pseudo-iperpotassiemia dovuta a : Fenomeni di emolisi in vitro; Nella coagulazione in vitro, vi è rilascio nel siero di K + dalle piastrine e dai globuli bianchi (in caso di leucocitosi o trombocitosi, il fenomeno aumenta); il fenomeno è più probabile in corso di terapia citotossica anti-leucemica a causa dell'elevato numero di leucociti neoplastici che vanno incontro a lisi intra-vascolare Rilascio di K + durante l esercizio fisico; Prolungata applicazione del laccio emostatico (se il sangue viene prelevato dopo una ripetuta chiusura del pugno della mano fatta eseguire per rendere prominenti i vasi venosi durante l'applicazione del laccio emostatico; ciò è dovuto alla perdita di potassio dal muscolo in esercizio).
58 CONSIDERAZIONI CLINICHE NELL IPER-KALIEMIA Gli effetti tossici più importanti dell'iper-kaliemia sono le aritmie cardiache: nelle fasi finali si può avere fibrillazione atriale e arresto cardiaco. Serio rischio di arresto cardiaco quando K + raggiunge >7mmoli/l (alterazioni dell ECG). Importante controllare la conc. K + dopo l arresto cardiaco. Talvolta l'iper-kaliemia moderata o grave ha effetti diretti sui muscoli periferici: ci può essere astenia muscolare ascendente che può arrivare alla quadriplegia flaccida e alla paralisi respiratoria Trattamento: Infusione di insulina e glucosio (spingere K + nelle cellule) Somministrazione di gluconato di Calcio (controbilanciare K + ) Dialisi (casi molto gravi) Somministrazione orale di una resina a scambio cationico
59 IPOPOTASSIEMIA (o IPOKALIEMIA): La concentrazione di K + < 3.5 mmoli/l Cause: Assunzione inadeguata Perdite gastrointestinali (vomito, diarrea, adenomi villosi, fistole) Perdite renali (alcalosi metabolica, diuretici, diuresi osmotica, eccessivi effetti mineralcorticoidi (iper-aldosteronismo primario, secondario ed ingestione di liquirizia), eccesso di glucocorticoidi (morbo di Cushing, steroidi esogeni, produzione ectopica di ACTH), malattie tubulari renali, deplezione di magnesio) Spostamento all interno delle cellule (effetto insulinico, paralisi periodica ipokaliemica, alcalosi, aumento attività α-adrenergica)
60 Sintomi: Debolezza muscolare, mancanza di riflessi, alterazioni neuromuscolari fino alla paralisi ipo-kaliemica Compromissione della funzione del tubulo renale Aritmie cardiache: cambiamenti nell ECG; arresto cardiaco Trattamento: Somministrazione di K + per endovena (casi gravi) e non deve essere somministrato a una velocità maggiore di 20 mmoli/ora, eccetto in casi gravissimi e sotto monitoraggio ECG. K + plasmatico dovrebbe essere monitorato nei pazienti in terapia insulinica
61 CLORO Il cloro non ha proprietà specifiche: la sua funzione è quella di accompagnare lo ione sodio negli spostamenti attraverso le membrane cellulari e garantire, quindi, l elettroneutralità ed il mantenimento della pressione osmotica Principale anione extracellulare : 70%, mmoli/l, valori di riferimento Concentrazione intracellulare : 30%, 1-3 mmoli/l Assunzione variabile: 70 mmoli-270 mmoli/die (4-6 g al giorno) Perdite: urine ( mmol/die) Fisiopatologia: Filtrato a livello glomerulare; Riassorbito nei tubuli prossimali (99,4%), seguendo passivamente il riassorbimento del sodio e del potassio, ed in parte nel tratto distale, dove il suo riassorbimento è condizionato dalla necessità di un ph ematico costante;
62 Lo ione cloro modifica la sua concentrazione nell ECF in senso opposto ai bicarbonati e secondo le necessità è ritenuto o eliminato attraverso i reni: Acidosi metabolica < [bicarbonati] Alcalosi metabolica > [bicarbonati] > cloremia (acidosi metabolica ipercloremica) < cloremia (alcalosi metabolica ipocloremica) IPERCLOREMIA insufficienza renale acuta acidosi tubulare renale disturbi dell equilibrio acido-base (alcalosi respiratoria, acidosi tubulare renale) somministrazione prolungata di soluzione fisiologica o di NH 4 Cl dopo trattamento con inibitori di anidrasi carbonica IPOCLOREMIA Vomito ripetuto ed abbondante Ostruzione pilorica, alcolismo L associato aumento di ioni bicarbonato determina un ALCALOSI IPOCLOREMICA grave insufficienza surrenalica con iposodiemia Trattamento prolungato con diuretici grave disidratazione
63 Metodi di misura Cloro: in passato usati metodi volumetrici (con sali di argento o di mercurio) e metodi colorimetrici (tiocianato di mercurio). Attualmente, le tecniche di titolazione coulombometrica e quelle potenziometriche (ISE) sono quelle più utilizzate.
64 Omeostasi degli ioni idrogeno nell organismo Gas ematici La concentrazione di ioni H + nel sangue si mantiene entro ristretti margini: nmoli/l (ph compreso tra 7,35-7,43) >120 nmoli/l e < 20nmoli/l sono incompatibili con la vita (range di sopravvivenza: ph 6,8-8,0) Il ph del sangue, così come altri parametri dell equilibrio acido-base, sono influenzati dall età, dal sesso, dalla posizione del corpo, dall alimentazione, dalla digestione, ecc.
65
66
67
68 L organismo umano è capace di produrre ogni giorno elevate quantità di composti acidi: ACIDI VOLATILI: acido carbonico ( mmol/die); ACIDI FISSI (NON VOLATILI): 80 mmol/die, prodotti dal metabolismo delle proteine introdotte con la dieta, degli zuccheri e dei grassi, dai composti organici fosforati, dalle nucleoproteine: Acido solforico (metabolismo proteico: metionina, cisteina) Acido fosforico (metabolismo fosfolipidi) Acido cloridrico (conversione cloruro di ammonio in urea) Acido lattico (acido organico) Corpi chetonici (Acido acetoacetico, β-idrossibutirrico)
69
70 Sistemi tampone nell organismo Sistemi tampone nei liquidi corporei (si combinano istantaneamente con acidi e basi per impedire variazioni consistenti del ph): risposta immediata Sistemi tampone nel sangue: Il plasma (ECF/LEC) contiene 4 sistemi tamponi importanti: Acido carbonico-bicarbonato di sodio (H 2 CO 3 - NaHCO 3 ); Fosfato monosodico-fosfato bisodico (NaH 2 PO 4 - Na 2 HPO 4 ); Proteina-Proteinato di sodio (HProt- NaProt); Acidi organici-sali di sodio degli acidi organici. Gli eritrociti (ICF/LIC) contengono 4 sistemi tamponi importanti: Acido carbonico-bicarbonato di potassio (H 2 CO 3 - KHCO 3 ); Fosfato monopotassico-fosfato bipotassico (KH 2 PO 4 - K 2 HPO 4 ); Proteina-Proteinato di potassio (HHb- KHb; HHbO 2 -KHbO 2 ); Acidi organici-sali di potassio degli acidi organici.
71 I tamponi intracellulari (ICF/LIC) sono costituiti da: Proteine Fosfati Emoglobina (negli eritrociti) I tamponi delle ossa sono costituiti da: Carbonati (importanti nei casi di acidosi grave, in quanto sottraggono H + stabilizzando i bicarbonati plasmatici)
72
73 Equazione di Henderson-Hasselbach per il bicarbonato La concentrazione del bicarbonato è sotto controllo renale, mentre la pressione parziale di CO 2 nell ECF è sotto controllo del sistema respiratorio: TALE TAMPONE HA IL VANTAGGIO DI ESSERE SOTTO IL CONTROLLO DI DUE SISTEMI NELLA REGOLAZIONE DEL ph.
74 Gli H + generati dal metabolismo cellulare (ICF) sono quindi: Immediatamente tamponati dalle proteine cellulari : H + + Prot. - H-Prot. (nell ICF) Successivamente, gli H + passano ai liquidi extracellulari e vengono intercettati dai bicarbonati: H + + HCO 3- H 2 CO 3 CO 2 + H 2 O (in TESSUTI/ECF)
75 P CO2 45 mmhg P CO2 40 mmhg nel sangue arterioso Diffusione nel plasma di HCO 3- in scambio con ioni Cl - nei GR (shift dei cloruri) gradiente pressorio Se la CO 2 penetra nel sangue, in presenza di acqua avviene la reazione: CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - (nell ECF, plasma) (8% CO 2 ) Nel plasma tale reazione è molto lenta (8% CO 2 totale), e solo una piccola parte di CO 2 forma H 2 CO 3 che, decomponendosi, libera H + tamponati poi da proteine. Negli eritrociti, invece, tale reazione è molto rapida per la presenza di ANIDRASI CARBONICA : CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - (nell ICF, per diffusione di CO 2 negli eritrociti) (65% CO 2 )
76 Gli H + prodotti vengono tamponati dall emoglobina: H + + O 2 Hb H-Hb + O 2 (nell ICF dei GR) (dal 65% CO 2 ) L emoglobina possiede capacità tamponante, che aumenta quando si libera O 2, per la presenza di gruppi acidi e basici: O 2 Hb- + CO 2 + CO 2 -Hb (carbaminoemoglobina, nell ICF) (27% CO 2 ) L'EMOGLOBINA (HB) È RESPONSABILE DEL TRASPORTO DELLA CO 2 DAI TESSUTI PERIFERICI AI CAPILLARI ALVEOLARI DA DOVE VIENE POI ESPULSA ATTRAVERSO L'ESPIRAZIONE (65%+27% di CO 2 eliminata) (ovviamente, distribuisce O 2 ai tessuti!!!!) Attraverso il meccanismo respiratorio (O 2 dai polmoni ai tessuti e CO 2 dai tessuti ai polmoni) sia l aumento che la diminuzione del ph sono compensati rapidamente modificando la frequenza respiratoria, e il ph del sangue, in condizioni normali, è costante.
77 Il rene nella omeostasi degli H + Si è visto che gli ioni H + provenienti dal metabolismo sono tamponati dai bicarbonati: H + + HCO 3- H 2 CO 3 CO 2 + H 2 O (nell ECF) E un sistema tamponante molto efficiente, sia per l elevata concentrazione di questi anioni rispetto ad altri (fosfati e proteine), e poi perché la CO 2 prodotta è efficacemente eliminata tramite il sistema respiratorio...tuttavia... Elevate quantità di H + prodotti dal metabolismo, anche non volatili quindi sistema bicarbonato destinato ad esaurirsi... NECESSITA DI RIGENERAZIONE DI HCO 3-, DI RIASSORBIMENTO DEL BICARBONATO ESISTENTE E DI ELIMINAZIONE DI H + COMPITO SVOLTO DAI RENI
78 ph URINA: 6.0 ph PLASMA: 7.4 Urina consente di eliminare sostanze acide
79
80
81 Tragitto H + + HCO 3- H 2 CO 3 CO 2 + H 2 O (nel PLASMA, ECF) Passa nelle cellule tubulari renali 2. CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - (nel TUBULO PROSSIMALE, dove c è molta AC) 4400 mmol/die SECRETI nel lume Una parte (80 mmol/die) è ESCRETA nel lume tubulare La gran parte N.B. Il (4320 Na + mmol/die) reagisce è scambiato con HCO con 3- H filtrato + nel lume tubulare per RIASSORBIRE HCO - 3 passa nel plasma: RIGENERAZIONE HCO 3 - Risultato netto: riassorbimento HCO 3- nel plasma, con ripristino della capacità tamponante dell ECF H + + HCO 3- H 2 CO 3 CO 2 + H 2 O nel lume
82
83 Dal fegato
84 Interessante è anche il ruolo svolto dal fegato...
85 ALTERAZIONI EQUILIBRIO ACIDO-BASE ACIDOSI Condizione patologica che produrrebbe un abbassamento del ph (per aggiunta di acidi o rimozione di alcali) del sangue, qualora non intervengano meccanismi di compensazione per riportare alla normalità il ph dei fluidi biologici. Acidosi metabolica Processo eziologico primario, in cui l alterazione principale è a carico della concentrazione di HCO 3-.
86 Cause (acidosi acute e croniche): Aumentata produzione di acidi fissi (chetoacidi, acido acetacetico e acido betaidrossibutirrico nell acidosi diabetica; acido lattico nell ipossia severa); Perdita di alcali e generale diminuzione di bicarbonati ematici; Aumentata ingestione di NH 4+, ad es. come sale di ammonio, (a livello epatico l ammonio è metabolizzato producendo urea, con formazione di una mole di H + per ogni mole di NH 4+ ); Diarrea o perdita di liquidi intestinali attraverso fistole comportano perdite di bicarbonati o di altre basi coniugate; Nelle malattie renali croniche si ha deficienza di secrezione di ammoniaca o scarso riassorbimento di bicarbonati delle urine Meccanismi di compensazione: il sistema neurale, che controlla la ventilazione alveolare, è sensibile all aumento di H + e di P CO2 e determina rapidamente (minuti) l aumento nella frequenza e nel volume del respiro
87 Dati di laboratorio: Riduzione del bicarbonato plasmatico (al di sotto di 24 meq/l); Riduzione del ph ematico (valori inferiori a 7,4); Riduzione (compensatoria) della P CO2 (valori inferiori a 40 mmhg); Iperpotassiemia; Con funzione renale normale, in acidosi metabolica si ha un aumento dell escrezione di H +, che inizialmente coinvolge il fosfato urinario, e che poi comporta l aumentata produzione di ioni ammonio
88 Acidosi respiratoria Processo eziologico primario, in cui l alterazione principale è a carico della ventilazione alveolare. Tale diminuzione provoca l aumento della P CO2, e dell acido carbonico: la CO 2 in eccesso, infatti, diffonde nelle emazie, dove, idratata, diventa ac. carbonico.
89 L ac. respiratoria acuta si manifesta per improvvisa depressione del centro respiratorio (per overdose di narcotici, anestesia, disordini del SNC, paralisi dei muscoli respiratori, ostruzione delle vie aeree da corpo estraneo, asma, trauma toracico). Dati di laboratorio: Riduzione del ph ematico (valori inferiori a 7,4) Aumento della P CO2 (valori superiori a 40 mmhg) Bicarbonato plasmatico normali (al di sopra di 24 meq/l) L ac. respiratoria cronica si manifesta nelle malattie polmonari croniche (enfisema); l aumento di P CO2 a livello renale determina un aumento dei bicarbonati. Il rene tende a compensare aumentando l escrezione con fosfati e ione ammonio. Dati di laboratorio: ph ematico normale all inizio (di compenso), diminuito successivamente Aumento della P CO2 (valori superiori a 40 mmhg) Bicarbonato plasmatico aumentati
90 ALCALOSI Condizione patologica che produrrebbe un aumento del ph (per diminuzione di acidi o aumento di alcali) del sangue, qualora non intervengano meccanismi di compensazione per riportare alla normalità il ph dei fluidi biologici. Alcalosi metabolica L alterazione principale è a carico della concentrazione di HCO 3-.
91 Cause: Diminuita concentrazione di H + nell ECF, causata da diminuzione di acidi fissi sia da un aumento delle basi, per: Diminuita produzione di acidi fissi (meno rilevante); Aumentata perdita di acidi (molto più rilevante, ad es. col vomito); Eccesso di bicarbonati o di altre basi coniugate. Dati di laboratorio: Aumento del bicarbonato plasmatico (al di sopra di 24 meq/l) Aumento della P CO2 (valori superiori a 40 mmhg) Ipopotassiemia
92 Alcalosi respiratoria Ventilazione alveolare in eccesso, rispetto al bisogno di eliminazione di CO 2 dall organismo. Sono svariate le cause che determinano iperventilazione: Durante i primi minuti di iperventilazione si ha rapida perdita di CO 2 dal sangue, con innalzamento del ph; il tamponamento extracellulare viene attuato mediante passaggio in senso inverso di Na + e K +. Contemporaneamente, si ha aumento di produzione di acido lattico e calo dei carbonati. Persistendo per alcune ore, il rene compensa diminuendo l escrezione urinaria di H + ed aumentando quella dei bicarbonati.
93
94 Emogasanalisi Perché fare il test? Per valutare la funzionalità polmonare misurando il ph, l ossigeno (O 2 ) e l anidride carbonica (CO 2 ); per monitorare il trattamento delle patologie polmonari; per determinare la presenza di uno squilibrio acido-base nel sangue, che può indicare patologie respiratorie, metaboliche o renali; per valutare l efficacia dell ossigenoterapia. Campione di scelta: è quasi sempre usato il sangue arterioso ma, in alcuni casi, come nei bambini, viene raccolto al suo posto, sangue capillare dal tallone. Il sangue può essere raccolto inoltre dal cordone ombelicale dei neonati. Un campione di sangue arterioso viene di solito raccolto dalle arterie radiali del polso, localizzate all interno del polso, sotto al pollice, dove si può sentire il battito. Il test di circolazione, chiamato test di Allen, deve essere eseguito prima del prelievo per essere sicuri che ci sia un adeguata circolazione nel polso del soggetto. Dopo il prelievo arterioso, deve essere applicata una pressione nella zona del prelievo per almeno 5
95 minuti. Dal momento che il sangue viene pompato attraverso le arterie, la puntura richiede un pò di tempo per smettere di sanguinare. Se l individuo sta prendendo dei fluidificanti del sangue o l aspirina, il sanguinamento può durare anche minuti. po 2 sangue venoso inferiore di mmhg rispetto a quello arterioso, mentre la pco 2 è superiore di 2-8 mmhg Eliminare tutta l aria dalla siringa (contiene un po di eparina). Minimo contatto con l aria atmosferica (la P CO2 dell aria è molto inferiore a quella del sangue, la po 2 dell aria è di 150 mmhg e supera di 60 mmhg quella del sangue arterioso e di 120 mmhg quella del sangue venoso. Conservare in ghiaccio durante il trasporto. E sufficiente misurare H + e la P CO2 (HCO - 3 si può ricavare dall equazione di Henderson- Hasselbach).
96 METODI DI MISURA ph Valori di riferimento: Tecnica potenziometrica (elettrodo a vetro combinato) P CO2 Valori di riferimento: mmhg Tecnica potenziometrica: elettrodo a vetro, immerso in una soluzione salina contenente bicarbonato e separato dal sangue da una membrana in teflon permeabile alla CO 2 ; all equilibrio c è una variazione di ph nella soluzione salina proporzionale al valore della P CO2. P O2 Valori di riferimento: mmhg Tecnica amperometrica (elettrodo di Clarke). HCO 3 Valori di riferimento: meq/l I bicarbonati possono essere misurati o indirettamente o direttamente previa alcalinizzazione del campione oppure misurando la CO 2 rilasciata dopo acidificazione
97 I disordini acido-base vanno curati trattando la malattia che c è alla base: Terapia idrica e insulina nella chetoacidosi diabetica Ventilazione artificiale nello stato asmatico acuto Miglioramento della GFR mediante ripristino del volume di sangue in un soggetto che ha avuto gravi perdite di sangue Nei casi gravi può essere presa in considerazione la somministrazione di HCO - 3
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano
 EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
Funzioni. Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto
 La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
ALTERAZIONI IDROELETTROLITICHE. ACIDO-BASE (2 parte) scaricato da EQUILIBRIO ACIDO-BASE (EAB) NECESSITA : EQUILIBRIO ACIDO-BASE
 (EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
(EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
Sodio. L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria
 Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
Acqua, elettroliti ed equilibrio acido-base
 Acqua, elettroliti ed equilibrio acido-base L adattamento dei mammiferi alla vita terrestre ha comportato lo sviluppo di complessi meccanismi fisiologici di controllo dell omeostasi che includono diversi
Acqua, elettroliti ed equilibrio acido-base L adattamento dei mammiferi alla vita terrestre ha comportato lo sviluppo di complessi meccanismi fisiologici di controllo dell omeostasi che includono diversi
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3-
 diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
Equilibrio idroelettrolitico
 Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA. Il paziente non ha problemi cardiaci ma iperpotassiemia
 PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE
 LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
Programma del Corso Testi consigliati
 Programma del Corso Equilibrio elettrolitico ed equilibrio acido-base. Funzione del rene e marcatori della malattia renale. Analisi delle urine. Proteine sieriche. Marcatori tumorali. Marcatori enzimatici
Programma del Corso Equilibrio elettrolitico ed equilibrio acido-base. Funzione del rene e marcatori della malattia renale. Analisi delle urine. Proteine sieriche. Marcatori tumorali. Marcatori enzimatici
Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina);
 Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
[H + ] X [A - ] [ HA ]
![[H + ] X [A - ] [ HA ] [H + ] X [A - ] [ HA ]](/thumbs/81/84332766.jpg) Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
Viene definita osmolalità la concentrazione totale dei soluti in un liquido. Più specificamente, l osmolalità sierica riflette la concentrazione di
 1 Viene definita osmolalità la concentrazione totale dei soluti in un liquido. Più specificamente, l osmolalità sierica riflette la concentrazione di osmoli per 1 kg di acqua plasmatica, mentre l osmolarità
1 Viene definita osmolalità la concentrazione totale dei soluti in un liquido. Più specificamente, l osmolalità sierica riflette la concentrazione di osmoli per 1 kg di acqua plasmatica, mentre l osmolarità
I pazienti con iponatremia si possono dividere in tre categorie sulla base del volume dell ECF
 I pazienti con iponatremia si possono dividere in tre categorie sulla base del volume dell ECF Iponatremia ipovolemica: Vengono persi acqua e maggiormente sodio Perdite renali Perdite extrarenali (vomito,
I pazienti con iponatremia si possono dividere in tre categorie sulla base del volume dell ECF Iponatremia ipovolemica: Vengono persi acqua e maggiormente sodio Perdite renali Perdite extrarenali (vomito,
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]
![Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$] Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]](/thumbs/92/108719223.jpg) Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua
 FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale La principale funzione dei reni è il bilancio idrosalino FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici,
Sistema urinario: la funzione renale La principale funzione dei reni è il bilancio idrosalino FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici,
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Fisiologia Renale 8. Bilancio idro-elettrolitico III. Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona
 Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
DISORDINI DELL EQUILIBRIO ACIDO - BASE
 DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
LEZIONE 28: RIASSORBIMENTO E SECREZIONE TUBULARE
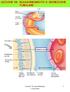 LEZIONE 28: RIASSORBIMENTO E SECREZIONE TUBULARE 1 2 capillare peritubulare 80% >19% : riassorbito 20% Frazione di filtrazione riassorbimento = movimento di soluti filtrati e di acqua dal lume tubulare
LEZIONE 28: RIASSORBIMENTO E SECREZIONE TUBULARE 1 2 capillare peritubulare 80% >19% : riassorbito 20% Frazione di filtrazione riassorbimento = movimento di soluti filtrati e di acqua dal lume tubulare
L anatomia dell apparato urinario
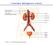 L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
La costanza di questi volumi dipende dall equilibrio tra assunzione ed eliminazione di acqua. Plasma 3 litri. Sistema linfatico. extracellulare (LEC)
 Equilibrio idrico-salino Liquidi corporei Plasma 3 litri Sistema linfatico Liquido extracellulare (LEC) 14 litri Endotelio capillare Liquido interstiziale 11 litri Nell adulto, in condizioni normali, i
Equilibrio idrico-salino Liquidi corporei Plasma 3 litri Sistema linfatico Liquido extracellulare (LEC) 14 litri Endotelio capillare Liquido interstiziale 11 litri Nell adulto, in condizioni normali, i
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:30-18:30
 a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
www.slidetube.it Il nefrone è costituito dal corpuscolo renale e dal tubulo
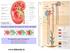 Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
Escrezione renale di Na + e sua regolazione
 Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra ). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg
 LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE. Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta
 CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA
 BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori:
 Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI
 CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
600 mosm/dì 1200 mosm/l. = 0.5 l/dì
 Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Omeostasi idro-elettrolitica
 Omeostasi idro-elettrolitica Riassorbimento idrico isoosmotico o obbligatorio Riassorbimento idrico non-isoosmotico o facoltativo Il bilancio idrico richiede l azione integrata di molteplici sistemi 1
Omeostasi idro-elettrolitica Riassorbimento idrico isoosmotico o obbligatorio Riassorbimento idrico non-isoosmotico o facoltativo Il bilancio idrico richiede l azione integrata di molteplici sistemi 1
FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI
 FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI DIURETICI Aumentano il flusso urinario e l escrezione dello ione Na + (e generalmente Cl - ) e vengono utilizzati per ripristinare il
FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI DIURETICI Aumentano il flusso urinario e l escrezione dello ione Na + (e generalmente Cl - ) e vengono utilizzati per ripristinare il
INDICE CAPITOLO 1. BASI BIOLOGICHE II. OMEOSTASI POTASSICA CONTENUTO TOTALE E DISTRIBUZIONE... 47
 INDICE Presentazione... 13 pag. Premesse... 15 Composizione degli oceani e comparsa della vita... 15 Apporto alimentare del sodio e del potassio e funzione escretoria renale dei due cationi... 16 Ipertensione
INDICE Presentazione... 13 pag. Premesse... 15 Composizione degli oceani e comparsa della vita... 15 Apporto alimentare del sodio e del potassio e funzione escretoria renale dei due cationi... 16 Ipertensione
Presentazione della collana (Ivo Casagranda)... Prefazione... Hanno collaborato...
 pag. Presentazione della collana (Ivo Casagranda).................. Prefazione............................................ Hanno collaborato....................................... XVII XIX XXI Capitolo
pag. Presentazione della collana (Ivo Casagranda).................. Prefazione............................................ Hanno collaborato....................................... XVII XIX XXI Capitolo
CONTROLLO DEL VOLUME DEI LIQUIDI CORPOREI
 CONTROLLO DEL VOLUME DEI LIQUIDI CORPOREI Il rene costituisce la principale via di escrezione di NaCl dall organismo; solo il 10% del sodio perso dall organismo ogni giorno segue vie non renali: feci e
CONTROLLO DEL VOLUME DEI LIQUIDI CORPOREI Il rene costituisce la principale via di escrezione di NaCl dall organismo; solo il 10% del sodio perso dall organismo ogni giorno segue vie non renali: feci e
Anatomia funzionale del rene
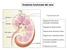 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Fisiologia Renale 6. Bilancio idro-elettrolitico I. Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona
 Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Raffaele Alvisi 14 gennaio 1916
 Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Potassio. Principale catione intracellulare (K + ) Peso molecolare 39 Range valori normali meq/l (o mmol/l)
 Potassio Principale catione intracellulare (K + ) Peso molecolare 39 Range valori normali 3.5 5.0 meq/l (o mmol/l) Partecipa alla regolazione dell attività elettrica cellulare Il potassio nell alimentazione
Potassio Principale catione intracellulare (K + ) Peso molecolare 39 Range valori normali 3.5 5.0 meq/l (o mmol/l) Partecipa alla regolazione dell attività elettrica cellulare Il potassio nell alimentazione
scaricato da sunhope.it Edema
 Edema rigonfiamento cutaneo evidente all esame obiettivo, quindi visibile e/o palpabile, da aumento liquido interstiziale sede consistenza evidenza localizzato, se alterazione non sistemica generalizzato,
Edema rigonfiamento cutaneo evidente all esame obiettivo, quindi visibile e/o palpabile, da aumento liquido interstiziale sede consistenza evidenza localizzato, se alterazione non sistemica generalizzato,
DEBOLE MEDIA FORTE FARMACI DIURETICI AD INTENSITÀ D AZIONE
 FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Principali funzioni renali
 FISIOLOGIA RENALE per le lezioni del prof. P. Paolo Battaglini v 3.5 Principali fonti delle figure: Conti et al., FISIOLOGIA MEDICA, Edi Ermes Guyton e Hall, FISIOLOGIA MEDICA, Elsevier Silverthorn, Fisiologia
FISIOLOGIA RENALE per le lezioni del prof. P. Paolo Battaglini v 3.5 Principali fonti delle figure: Conti et al., FISIOLOGIA MEDICA, Edi Ermes Guyton e Hall, FISIOLOGIA MEDICA, Elsevier Silverthorn, Fisiologia
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
I tre sistemi per la regolazione del ph
 I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
domande iniziali Obiettivi della fluido terapia aspetti fisiologici solidi interstizio 14% LIC plasma transcellulare LEC = 20 %
 domande iniziali quando si deve praticare? quale tipo di soluz. impiegare? quanto liquido somministrare? con quale velocità di infusione? quale via di somministrazione? Obiettivi della fluido terapia Risoluzione
domande iniziali quando si deve praticare? quale tipo di soluz. impiegare? quanto liquido somministrare? con quale velocità di infusione? quale via di somministrazione? Obiettivi della fluido terapia Risoluzione
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Equilibrio acido-base: il ph è importante
 Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI
 OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Disordini dell Acqua e degli Elettroliti
 Disordini dell Acqua e degli Elettroliti Bilancio idroelettrolitico quotidiano (valori medi) INTROITO ELIMINAZIONE URINE PELL POLMO FECI ACQUA (litri) E NI Bevande 1.2 Alimenti 1.0 Ossidazione 0.3 Totale
Disordini dell Acqua e degli Elettroliti Bilancio idroelettrolitico quotidiano (valori medi) INTROITO ELIMINAZIONE URINE PELL POLMO FECI ACQUA (litri) E NI Bevande 1.2 Alimenti 1.0 Ossidazione 0.3 Totale
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento.
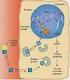 Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
ESCREZIONE. processo attraverso il quale il farmaco e i suoi metaboliti vengono eliminati dall organismo
 ESCREZIONE processo attraverso il quale il farmaco e i suoi metaboliti vengono eliminati dall organismo Vie di escrezione: renale biliare polmonare cutanea salivare lacrimale mammaria ESCREZIONE RENALE
ESCREZIONE processo attraverso il quale il farmaco e i suoi metaboliti vengono eliminati dall organismo Vie di escrezione: renale biliare polmonare cutanea salivare lacrimale mammaria ESCREZIONE RENALE
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
Riassorbimento dell acqua lungo il nefrone
 Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
La eliminazione dei protoni nelle urine permette il ripristino di bicarbonato nel circolo sistemico.
 ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
Il glomerulo. Membrana di filtrazione è formata da:
 Il glomerulo Fessure di filtrazione Membrana di filtrazione è formata da: Endotelio capillare (fenestrato, tappezzato da cariche negative fisse che ostacolano il passaggio delle proteine plasmatiche, cariche
Il glomerulo Fessure di filtrazione Membrana di filtrazione è formata da: Endotelio capillare (fenestrato, tappezzato da cariche negative fisse che ostacolano il passaggio delle proteine plasmatiche, cariche
Siti. d azione dei diuretici
 Siti d azione dei diuretici I diuretici aumentano la velocità del flusso urinario e la natriuresi (maggiore velocità di escrezione di Na + ). Modificano anche l escrezione di vari ioni: K +, H +,Cl - e
Siti d azione dei diuretici I diuretici aumentano la velocità del flusso urinario e la natriuresi (maggiore velocità di escrezione di Na + ). Modificano anche l escrezione di vari ioni: K +, H +,Cl - e
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
ANTIPERTENSIVI. Diuretici. (n.b. non solo antiipertensivi) DIURETICO: agente che aumenta il volume delle urine in un determinato periodo di tempo
 ANTIPERTENSIVI Diuretici (n.b. non solo antiipertensivi) Tecnicamente: DIURETICO: agente che aumenta il volume delle urine in un determinato periodo di tempo NATRIURETICO: agente che induce un aumento
ANTIPERTENSIVI Diuretici (n.b. non solo antiipertensivi) Tecnicamente: DIURETICO: agente che aumenta il volume delle urine in un determinato periodo di tempo NATRIURETICO: agente che induce un aumento
4ª UNITA DIDATTICA Modello Nutrizionale metabolico
 4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
acqua, CO 2, O 2, sali e ioni H +
 Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Il sodio è lo ione che influenza maggiormente gli spostamenti di acqua a causa della sua abbondanza nel plasma sanguigno
 ELETTROLITI Sodio Il sodio è lo ione che influenza maggiormente gli spostamenti di acqua a causa della sua abbondanza nel plasma sanguigno Concentrazione di sodio nei fluidi extracellulari = 140 mm Se
ELETTROLITI Sodio Il sodio è lo ione che influenza maggiormente gli spostamenti di acqua a causa della sua abbondanza nel plasma sanguigno Concentrazione di sodio nei fluidi extracellulari = 140 mm Se
Le funzioni dell acqua
 Le funzioni dell acqua Principio nutritivo non energetico L acqua: costituisce il solvente di numerosi composti presenti nell organismo e permette il trasporto dei nutrienti. serve a mantenere costante
Le funzioni dell acqua Principio nutritivo non energetico L acqua: costituisce il solvente di numerosi composti presenti nell organismo e permette il trasporto dei nutrienti. serve a mantenere costante
Trasporto epiteliale
 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
BCM NOME COGNOME MATRICOLA
 BCM COG 1 1 Trasporti attivi e trasporti passivi attraverso la membrana plasmatica 2 Ruolo del calcio nella contrazione del muscolo striato scheletrico 3 Il ritorno venoso: fattori che lo determinano e
BCM COG 1 1 Trasporti attivi e trasporti passivi attraverso la membrana plasmatica 2 Ruolo del calcio nella contrazione del muscolo striato scheletrico 3 Il ritorno venoso: fattori che lo determinano e
ALTERAZIONI IDROELETTROLITICHE
 ALTERAZIONI IDROELETTROLITICHE EQUILIBRIO IDROELETTROLITICO RUOLO DEL RENE: Il rene è l organo deputato al mantenimento dell equilibrio idrico ed elettrolitico dell organismo EQUILIBRIO IDROELETTROLITICO
ALTERAZIONI IDROELETTROLITICHE EQUILIBRIO IDROELETTROLITICO RUOLO DEL RENE: Il rene è l organo deputato al mantenimento dell equilibrio idrico ed elettrolitico dell organismo EQUILIBRIO IDROELETTROLITICO
Proprietà colligative
 Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Meccanismo di moltiplicazione controcorrente
 Equilibrio idroelettrolitico Dr. Alessandro Capitanini Meccanismo di moltiplicazione controcorrente Body Fluids 28 litri Acqua corporea totale in uomo di 70 kg = 42 litri Ambiente interno in equilibrio
Equilibrio idroelettrolitico Dr. Alessandro Capitanini Meccanismo di moltiplicazione controcorrente Body Fluids 28 litri Acqua corporea totale in uomo di 70 kg = 42 litri Ambiente interno in equilibrio
L escrezione e l osmoregolazione
 L escrezione e l osmoregolazione 1 Gli scarti metabolici degli animali sono di tre tipi, secondo l ambiente La scissione delle biomolecole produce degli scarti azotati. Quando gli amminoacidi vengono degradati,
L escrezione e l osmoregolazione 1 Gli scarti metabolici degli animali sono di tre tipi, secondo l ambiente La scissione delle biomolecole produce degli scarti azotati. Quando gli amminoacidi vengono degradati,
Il Potassio è il principale catione intracellulare (K+) Si verifica per il Potassio la situazione inversa a quella del Sodio.
 POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
Interpretazione dell emogasanalisi
 Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
