Energia di attivazione
|
|
|
- Giuliano Barbato
- 7 anni fa
- Visualizzazioni
Transcript
1 1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli enzimi
2 2 Energia di attivazione Y si trova ad uno stato energetico inferiore rispetto a X Conversione X Y termodinamicamente favorevole Ma la reazione non avviene se X non acquisisce sufficiente energia per superare la barriera dell energia di attivazione
3 3 Numero di molecole Distribuzione delle molecole a vari livelli di energia Energia di attivazione Molecole con energia maggiore dell energia di attivazione Energia Aumento di temperatura Presenza di un catalizzatore
4 4 Energia A Energia di attivazione Energia di attivazione senza catalizzatore Stato iniziale Energia di attivazione con catalizzatore Energia liberata dalla reazione P Stato finale
5 5 Enzimi: catalizzatori biologici Si combinano transientemente col substrato e ne abbassano l energia di attivazione Non modificano l equilibrio della reazione, ma solo la velocità con la quale l equilibrio viene raggiunto Non vengono modificati nella reazione, e al termine della reazione sono subito disponibili per catalizzare una nuova reazione Stabilizzano lo stato di transizione e riducono la barriera dell energia di attivazione inserendo stati di transizione di livello energetico più basso
6 6 DNA RNA ribosomi Struttura generale degli enzimi Zimogeno (precursore) Substrato Apoenzima Prodotto Sito attivo ENZIMA ATTIVO Parte non proteica ione metallico o coenzima Sito allosterico Ubiquitina Lisosomi degradazione Effettore allosterico
7 7 Nomenclatura degli enzimi Denominazione classica costituita da 3 parti: Nome del substrato Nome del coenzima Nome della reazione catalizzata + asi Esempio: Lattico NAD deidrogenasi International Enzyme Commission, fondata nel 1956 da Prof. M. Florkin, International Union of Biochemistry: Classificazione degli enzimi secondo il sistema delle classi EC Esempi: Creatin kinasi: EC , adenosintrifosfato : creatin N fosfo trasferasi Lattato deidrogenasi: EC , lattato : NAD+ ossidoreduttasi Ha funzionato bene fino agli anni 90 (circa 3200 enzimi) Esistono circa 20,000 geni, di cui almeno 1/4 1/3 sono enzimi Progetto genoma umano (HUGO):
8 8 Classificazione internazionale degli enzimi 1 ossidoreduttasi: reazioni di ossido riduzione 1.1 agisce sul gruppo CHOH del donatore 1.2 agisce sul gruppo aldeidico o chetonico del donatore 1.3 agisce sul gruppo CH CH del donatore 1.4 agisce sul gruppo CH NH2 del donatore 1.5 agisce sul gruppo C NH del donatore 1.6 agisce su NADH2 o NADPH2 1.7 agisce su altri composti azotati 1.8 agisce su gruppi solforati 1.9 agisce sui gruppi eme
9 9 Classificazione internazionale degli enzimi 1 ossidoreduttasi: reazioni di ossido riduzione 2 transferasi: trasferimento di gruppi chimici da una molecola ad un'altra 2.1 gruppi ad una unità di carbonio 2.2 gruppi chetonici o aldeidici 2.3 gruppi acilici 2.4 gruppi glicosidici 2.5 gruppi alchilici 2.6 gruppi azotati 2.7 gruppi fosforici 2.8 gruppi contenenti zolfo
10 10 Classificazione internazionale degli enzimi 1 ossidoreduttasi: reazioni di ossido riduzione 2 transferasi: trasferimento di gruppi chimici da una molecola ad un'altra 3 idrolasi: reazioni di idrolisi 3.1 legami esterei 3.2 legami glicosidici 3.3 altri legami 3.4 legami peptidici 3.5 legami C N non peptidici 3.6 legami anidridici 3.7 legami C C
11 11 Classificazione internazionale degli enzimi 1 ossidoreduttasi: reazioni di ossido riduzione 2 transferasi: trasferimento di gruppi chimici da una molecola ad un'altra 3 idrolasi: reazioni di idrolisi 4 liasi: reazioni di addizione a doppi legami 4.1 legami C = C 4.2 legami C = O 4.3 legami C = N 4.4 legami C = S
12 12 Classificazione internazionale degli enzimi 1 ossidoreduttasi: reazioni di ossido riduzione 2 transferasi: trasferimento di gruppi chimici da una molecola ad un'altra 3 idrolasi: reazioni di idrolisi 4 liasi: reazioni di addizione a doppi legami 5 isomerasi: reazioni di trasformazione di una molecola nel suo isomero 5.1 racemasi 5.2 cis trans isomerasi
13 13 Classificazione internazionale degli enzimi 1 ossidoreduttasi: reazioni di ossido riduzione 2 transferasi: trasferimento di gruppi chimici da una molecola ad un'altra 3 idrolasi: reazioni di idrolisi 4 liasi: reazioni di addizione a doppi legami 5 isomerasi: reazioni di trasformazione di una molecola nel suo isomero 6 ligasi: reazioni di formazione di nuovi legami con rottura di ATP in AMP e pirofosfato o ADP e Pi 6.1 legami C O 6.2 legami C S 6.3 legami C N 6.4 legami C C
14 14 Classificazione internazionale degli enzimi 1 ossidoreduttasi: reazioni di ossido riduzione 2 transferasi: trasferimento di gruppi chimici da una molecola ad un'altra 3 idrolasi: reazioni di idrolisi 4 liasi: reazioni di addizione a doppi legami 5 isomerasi: reazioni di trasformazione di una molecola nel suo isomero 6 ligasi: reazioni di formazione di nuovi legami con rottura di ATP in AMP e pirofosfato o ADP e Pi
15 15 Struttura primaria e mutazioni genetiche Tutte le funzioni delle proteine necessitano del riconoscimento fra zone della proteina e altre molecole o parti di molecola: Enzima substrato, molecole di adesione membrane, anticorpo antigene etc Il riconoscimento è basato sulla distribuzione dei gruppi R e quindi sulla sequenza degli aminoacidi La zona di riconoscimento e la molecola da riconoscere devono essere complementari in termini di struttura e di carica Ogni alterazione della struttura primaria può impedire il riconoscimento o renderlo difficile, causando disfunzioni più o meno gravi Se ne deriva uno stato patologico, quella mutazione interessa la zona di riconoscimento Se la mutazione è silente (non genera malattie o disfunzioni), è possibile che l'aminoacido mutato non è nella zona di riconoscimento
16 16 Modello Lock and Key: l enzima si combina chimicamente col substrato Il sito attivo è costituito dal negativo del substrato Si formano legami ionici e elettrostatici esatti fra enzima e substrato Riconoscimento spesso tridimensionale Esempio: glicerol kinasi (lega solo glicerolo in forma alfa) Gli enzimi possono distinguere gli stereoisomeri D e L degli aminoacidi
17 Il legame enzima substrato avviene tramite l interazione delle cariche del substrato con alcuni aminoacidi del sito attivo Esempio: proteasi a serina Modifiche della struttura primaria di un enzima possono mutarne l attività causando malattie genetiche 17
18 18 Il legame enzima substrato induce un cambiamento conformazionale nell enzima Esempio: esochinasi senza e con glucosio
19 19 Coenzimi Piccole molecole organiche, spesso derivate da vitamine Si legano con forte affinità a enzima e substrato Spesso fungono da secondo substrato Determinano la specificità della reazione catalizzata
20 20 Adenosin trifosfato (ATP) Coenzima delle chinasi, trasferisce un gruppo Pi al substrato Esempio: Glucosio + ATP Glucosio 6 fosfato + ADP In molte chinasi, il substrato vero è Mg ATP
21 21 Nicotinamide Adenina Dinucleotide (NAD+) Coenzima di deidrogenasi Derivato da niacina Trasferisce un protone da/a substrati: lattato + NAD+ + piruvato + NADH + H Esiste una forma+ fosforilata NADP
22 22 Flavina adenina dinucleotide (FAD) Coenzima di deidrogenasi Derivato da riboflavina (vit. B6) Trasferisce due protoni da/a substrati Esempio: Succinato + FAD Fumarato + FADH2
23 23 Coenzima A Trasportatore e attivatore di gruppi acilici (acidi grassi) e di acetato
24 24 Metalli di transizione (Fe, Zn, Cu, Mn ) Cofattori più che coenzimi Presenti in 2/3 degli enzimi Agiscono come stabilizzatori della proteina e come donatori/ accettori di elettroni (acidi di Lewis), per esempio i citocromi
25 25 Di tutte le reazioni possibili per un substrato, l enzima ne favorisce una sola Gli enzimi forzano le vie metaboliche attraverso reazioni selezionate (ad es: A > B > H > K > N > T > Z) favorendo il flusso unidirezionale di materiale
26 26 CINETICHE CHIMICHE E ENZIMATICHE Studio della velocità di trasformazione dei reagenti in prodotti Effetto della concentrazione di reagente Ordine di una reazione
27 27 Cinetiche chimiche (A P) Concentrazione di prodotto Vt Equilibrio V iniziale d[a] d[p] n velocità = v = = = k[a] dt dt k=costante di velocità n=numero intero 1 3 Tempo
28 28 Cinetiche chimiche (A P) Conc. di prodotto Conc. di substrato Velocità V iniziale V finale Tempo Tempo Tempo
29 29 Effetto della concentrazione di A (A P) A4 > A3 > A2 > A1 [prodotto] Velocità iniziale A4 A3 A2 A1 Tempo A1 A2 A3 A4 [A]
30 30 Cinetiche chimiche vs cinetiche enzimatiche Velocità iniziale Cinetica enzimatica Cinetica chimica [A]
31 31 Ordine di reazione Primo ordine A P v=k[a]1, n=1 Secondo ordine Pseudo primo ordine Ordine zero A + B P v=k[a]1[b]1, n=2 A + B P v=k[a]1[b]1, n=2 ma se [B]»[A], v=k[a]1, n=1 v=k, n=0 v dipende solo dalla concentrazione del catalizzatore
32 32 Ipotesi per l azione degli enzimi N.B.: [S] >> [E] E + S ES EP E + P L enzima si lega col substrato per formare ES: reazione reversibile e relativamente lenta Il complesso ES subisce il cambiamento conformazionale che induce la formazione di P L enzima rilascia P e torna nello stato iniziale La velocità globale è regolata dalla formazione di ES
33 33 Interazione enzima substrato v0 Vmax Se [S] è molto alto, v0 non cambia all aumentare di [S] Ordine 0 Ordine misto 1 ordine Se [S] è alto, v0 è controllata da [E] Se [S] è intermedio, v0 è controllata sia da [S], sia da [E] Se [S] è basso, v0 è controllata da [S] [substrato]
34 34 Raccomandazioni della Commission on Enzyme Nomenclature of the International Union of Biochemistry Attività enzimatica: quantità di substrato convertito per minuto in condizioni standard di temperatura, ph e forza ionica (moli/tempo) 1 katal = 1 mol/s 1 IU = 1 micromole/min Costante catalitica o numero di turnover: attività enzimatica per mole di enzima (moli/tempo/mole enzima) Attività specifica di un enzima: attività enzimatica per mg di proteina (moli/tempo/mg proteina) Espressione di purezza in una preparazione
35 35 Equazione di Michaelis Menten (1913) Vmax [S] v0 = K M + [S] Leonor Michaelis & Maud Menten
36 36 Assunzioni di Michaelis Menten E + S ES E + P 1 solo substrato Fattore limitante: formazione di ES Tutto E ES Non esiste E libero E saturo di S ES stazionario
37 37 Ipotesi v0=vmax/2 K = [S] quando v =V E una concentrazione M 0 /2 max (dimensioni moli/litro) E indipendente da [E] Vmax [S] v0 = K M + [S] Vmax Vmax [S ] = 2 K M + [S] 1 [S] = 2 K M + [S] K M + [S] = 2 [S] K M = [S]
38 38 Rappresentazione grafica delle reazioni enzimatiche v0 Vmax Vmax/2 KM [S]
39 39 Trasformazione di Lineweaver Burk Vmax [S] v0 = K M + [S] 1 K M + [S] = v0 Vmax [S] 1 KM [S] = + v0 Vmax [S] Vmax [S] Y 1 KM 1 1 = + v0 Vmax [S] Vmax X
40 40 Rappresentazione grafica delle reazioni enzimatiche 1 KM 1 1 = + v0 Vmax [S] Vmax 1/v0 1/Vmax 1/KM 1/[S]
41 41 Rappresentazione grafica delle reazioni enzimatiche Grafico di Lineweaver Burk V0 1/V0 Vmax Vmax/2 1/Vmax KM [S] 1/KM 1/[S]
42 42 REGOLAZIONE DELL ATTIVITÀ ENZIMATICA Necessità fisiologica della regolazione dell attività enzimatica Controllo del livello di enzima Modulazione dell attività dell enzima
43 43 Il buon funzionamento della cellula richiede che le varie attività enzimatiche siano regolate In condizioni di stato stazionario, i processi cellulari non funzionano mai al massimo delle loro capacità, ma possono anche venire completamente disattivati in alcune condizioni Ciò consente di: non produrre prodotti inutili economizzare l energia cellulare aumentare rapidamente l attività quando necessario
44 44 Reversibilità delle reazioni enzimatiche L enzima favorisce il raggiungimento dell equilibrio, quindi in teoria catalizza anche la reazione inversa A B Ma, se B è substrato di una reazione successiva, la prima reazione diventa praticamente irreversibile A B C Ciò vale per catene anche molto lunghe di reazioni (catene enzimatiche) A B C D E Anche se le singole reazioni enzimatiche sono reversibili (specie quelle con G 0), in pratica il flusso è unidirezionale perché il prodotto di una reazione funge da substrato per la reazione successiva Spesso il prodotto terminale di una sequenza di reazioni (E) inibisce il deflusso della stessa catena a livello della prima reazione A B L accumulo di E chiude il rubinetto La mancanza di E riapre il rubinetto A B C D E
45 45 Caratteristiche generali delle reazioni regolatorie G<<0 (maggior efficacia) Precoci nella catena enzimatica Inibizione o regolazione da parte del prodotto finale Gli enzimi coinvolti sono spesso multimerici Capacità catalitica = (concentrazione di enzima) x (efficienza catalitica)
46 46 Controllo della concentrazione di enzima (regolazione lenta) Regola generale: Tutte le strutture cellulari ed extracellulari (ad eccezione dell eritrocita umano) sono sottoposte a ricambio ed equilibrio dinamico Quindi, ad ogni istante, il livello di un enzima dipende da: Velocità di sintesi della proteina Velocità di trasformazione da zimogeno (o pro enzima) in enzima attivo Velocità di degradazione
47 47 Velocità di sintesi Può aumentare in seguito all accumulo intracellulare del substrato (es: operon del lattosio) Può aumentare in presenza di induttori gratuiti senza relazione col substrato Può essere repressa dai prodotti terminali della catena enzimatica (es: alcuni aminoacidi (His, Leu), effetto glucosio in E.coli)
48 48 Chimotripsinogeno chimotripsina
49 49 Attivazione degli zimogeni pancreatici mediante taglio proteolitico
50 50 Funzioni biologiche della proteolisi ubiquitina dipendente Regolazione del ciclo cellulare Essenziale per uscire dalla fase mitotica e separare i cromosomi durante mitosi e meiosi Malfunzionamenti causano formazione di cellule con numero anomalo di cromosomi (Down e tumori solidi) Riparazione del DNA, cancro e apoptosi Essenziale per mantenere il livello di p53 (il guardiano del genoma) Risposte immunologiche e infiammatorie Regolazione di NF kb (fattori di trascrizione) per attivare l espressione genica Generazione di peptidi MHC (difesa contro le infezioni virali) Fibrosi cistica Coinvolta nella mutazione di CFTR (transmembrane conductance regulator)
51 51 Compartimentalizzazione Si può ottenere un forte aumento di concentrazione di molecole compartimentalizzandole in una zona delimitata da una membrana
52 52 Modulazione dell attività dell enzima (regolazione veloce) ph Temperatura Inibizione reversibile ed irreversibile: Competitiva Non competitiva Uncompetitiva Modificazioni allosteriche Modificazioni covalenti
53 53 ph e attività enzimatica Ogni enzima ha il suo ph ottimale Il ph ottimale può non corrispondere col ph in cui si trova l enzima Attività ph
54 54 Temperatura e attività enzimatica à Attivit Aumento dovuto alla temperatura ( ogni 10 C) 0 Diminuzione dovuta alla denaturazione della proteina Risultato Temperatura Per ogni enzima, esiste una temperatura ottimale La temperatura ottimale può non corrispondere con la temperatura in cui si trova l enzima (37 C)
55 55 Inibizione competitiva e non competitiva Competitiva: Non competitiva: S e I si legano al sito attivo, Quando E lega I, cambia la EI è inattivo conformazione e diventa inattivo
56 56 Inibizione competitiva I simile a S, compete con S per il sito attivo di E Inibizione reversibile all aumentare di [S] V non cambia, K aumenta max M v0 1/v0 Vmax inibitore inibitore Vmax/2 1/Vmax KM [S] 1/KM 1/[S]
57 57 Esempi di inibizione enzimatica competitiva CH3OH CH3 CH2OH Metanolo Etanolo
58 58 Esempi di inibizione enzimatica competitiva Metotrexato o antifolato, antileucemico che rallenta la biosintesi di purine e pirimidine
59 59 Esempi di inibizione enzimatica competitiva Fluorouracile, analogo della mercaptopurina
60 60 Esempi di inibizione enzimatica competitiva Substrati suicidi o antimetaboliti, prevengono la reazione col substrato e/o disattivano l enzima Penicillina inibisce transpeptidasi che stabilizza le membrane batteriche
61 61 Inibizione non competitiva I reagisce su un sito diverso dal sito attivo Tende a disattivare E Inibizione non reversibile all aumentare di [S] K non cambia, V diminuisce M max v0 1/v0 inibitore inibitore Vmax 1/Vmax Vmax/2 KM [S] 1/KM 1/[S]
62 62 Esempi di inibizione non competitiva Degradazione proteica (temperatura, estremi di ph) Molti veleni e composti mercuriali (reagiscono con SH dei residui di Cys) Cianuro, reagisce con gli ioni metallici degli enzimi della catena respiratoria Diisopropil fluorofosfato (Sarin), gas nervino, inibisce gli enzimi contenenti Ser (acetilcolinesterasi)
63 63 Inibizione uncompetitiva I si lega al complesso ES
64 64 Inibizione uncompetitiva L inibitore reagisce con il complesso ES Cambiamenti simultanei di K e V M max V0 1/V0 + inibitore Vmax + inibitore 1/Vmax KM [S] 1/KM 1/[S]
65 65 Modificazioni covalenti degli enzimi La fosforilazione AUMENTA l attività di alcuni enzimi Glicogeno fosforilasi, citrato liasi, fosforilasi b chinasi, HMG CoA reduttasi chinasi e altri... La fosforilazione DIMINUISCE l attività di altri enzimi Acetil CoA carbossilasi, glicogeno sintasi, piruvato deidrogenasi, HMG CoA reduttasi e altri...
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi
 1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
Casi più complicati. inibizione mista (competitiva e non competitiva)
 Casi più complicati inibizione mista (competitiva e non competitiva) reazioni reversibili reazioni a più substrati effetto del ph inibizione mista (competitiva e non competitiva) K I K I E + I EI ES +
Casi più complicati inibizione mista (competitiva e non competitiva) reazioni reversibili reazioni a più substrati effetto del ph inibizione mista (competitiva e non competitiva) K I K I E + I EI ES +
ενζυµον ( nel lievito ): un po di storia...
 ENZIMI CATALISI ENZIMATICA. Meccanismo d azione degli enzimi; Energia dl attivazione; Componenti strutturali e funzionali; Nomenclatura e classificazione; Specificità dl substrato ed azione; Modello Lock
ENZIMI CATALISI ENZIMATICA. Meccanismo d azione degli enzimi; Energia dl attivazione; Componenti strutturali e funzionali; Nomenclatura e classificazione; Specificità dl substrato ed azione; Modello Lock
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
proteine enzimi RNA ribozimi substrati altamente specifici -asi
 I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
2. Quale delle seguenti affermazioni relative ad una reazione enzimatica è vera?
 1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
CATALISI COVALENTE. H 2 O Enz-R-OH + P. Enz-R-O S Enz-R-O-S
 CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA
 Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Enzimi e loro ruolo nel metabolismo
 Enzimi e loro ruolo nel metabolismo Definizioni e ruoli degli enzimi Cinetica enzimatica Localizzazione degli enzimi Enzimi come bersaglio di farmaci Enzimi come markers in Biochimica Clinica Errori congeniti
Enzimi e loro ruolo nel metabolismo Definizioni e ruoli degli enzimi Cinetica enzimatica Localizzazione degli enzimi Enzimi come bersaglio di farmaci Enzimi come markers in Biochimica Clinica Errori congeniti
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Regolazione dell attività enzimatica. Allosteria Modificazioni covalenti Isoenzimi
 Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
STRUTTURA E MECCANISMI D AZIONE DEGLI ENZIMI
 STRUTTURA E MECCANISMI D AZIONE DEGLI ENZIMI Confronto tra gli enzimi e i catalizzatori chimici Gli enzimi sono caratterizzati da: Velocità di reazione più elevate Condizioni di reazione più moderate
STRUTTURA E MECCANISMI D AZIONE DEGLI ENZIMI Confronto tra gli enzimi e i catalizzatori chimici Gli enzimi sono caratterizzati da: Velocità di reazione più elevate Condizioni di reazione più moderate
Esercitazione Esempi di domande del 2 test
 Esercitazione Esempi di domande del 2 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Esercitazione Esempi di domande del 2 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Nicotinamide adenin dinucleotide (NAD + ) H - NMN R AMP. Nel NADP + questo gruppo ossidrilico è esterificato con un gruppo fosforico
 Nicotinamide adenin dinucleotide (NAD + ) H - NMN R AMP Nel NADP + questo gruppo ossidrilico è esterificato con un gruppo fosforico FMN riboflavina. FADH. (FMNH. ) (semichinone) AMP Flavin adenin dinucleotide
Nicotinamide adenin dinucleotide (NAD + ) H - NMN R AMP Nel NADP + questo gruppo ossidrilico è esterificato con un gruppo fosforico FMN riboflavina. FADH. (FMNH. ) (semichinone) AMP Flavin adenin dinucleotide
2015 /2016. scaricato da
 Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
ENZIMI. Molecole proteiche globulari che consentono alle reazioni biochimiche di procedere ad una velocità adeguata alle
 ENZIMI Molecole proteiche globulari che consentono alle reazioni biochimiche di procedere ad una velocità adeguata alle condizioni fisiologiche Aumentano la velocità delle reazioni senza alterarne l equilibrio
ENZIMI Molecole proteiche globulari che consentono alle reazioni biochimiche di procedere ad una velocità adeguata alle condizioni fisiologiche Aumentano la velocità delle reazioni senza alterarne l equilibrio
PRINCIPALI CARATTERISTICHE DEGLI ENZIMI. 1) Aumentano la velocità di reazione. 2) Non modificano l equilibrio della reazione
 PRINCIPALI CARATTERISTICHE DEGLI ENZIMI 1) Aumentano la velocità di reazione 2) Non modificano l equilibrio della reazione S P 3) Presentano specificità di reazione 4) Richiedono condizioni di reazione
PRINCIPALI CARATTERISTICHE DEGLI ENZIMI 1) Aumentano la velocità di reazione 2) Non modificano l equilibrio della reazione S P 3) Presentano specificità di reazione 4) Richiedono condizioni di reazione
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA
 Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
3) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Esercitazione Esempi di domande del 1 test
 Esercitazione Esempi di domande del 1 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Esercitazione Esempi di domande del 1 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Il laboratorio di Biochimica si svolgerà nei seguenti giorni;
 Il laboratorio di Biochimica si svolgerà nei seguenti giorni; Lunedì 7 marzo 2016 Lezione 9-11 aula 1 Martedì 8 marzo Mercoledì 9 marzo ESERCITAZ. Lab. PP1 Giovedì 10 marzo 14:00-18:00 La frequenza è obbligatoria
Il laboratorio di Biochimica si svolgerà nei seguenti giorni; Lunedì 7 marzo 2016 Lezione 9-11 aula 1 Martedì 8 marzo Mercoledì 9 marzo ESERCITAZ. Lab. PP1 Giovedì 10 marzo 14:00-18:00 La frequenza è obbligatoria
Una panoramica del ciclo dell acido ciclico
 Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Informazioni sul corso a.a v.1. Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore
 Informazioni sul corso a.a 2017-18 v.1 Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore Informazioni sul corso Marco Scocchi Dip. Di Scienze della Vita - Prof. Associato Tel. 040-5588704 mscocchi@units.it
Informazioni sul corso a.a 2017-18 v.1 Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore Informazioni sul corso Marco Scocchi Dip. Di Scienze della Vita - Prof. Associato Tel. 040-5588704 mscocchi@units.it
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Aerobiosi C A T A B O L I S M O. Lez 4A. Schema generale del metabolismo dei glucidi
 Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Determinazione dell attività enzimatica
 Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Respirazione cellulare: processi molecolari medianti i quali le cellule consumano O 2 e producono CO 2
 AVVERTENZA Il presente materiale didattico è messo a disposizione degli studenti per facilitare la comprensione degli argomenti trattati nel corso delle lezioni e lo studio individuale Non sostituisce
AVVERTENZA Il presente materiale didattico è messo a disposizione degli studenti per facilitare la comprensione degli argomenti trattati nel corso delle lezioni e lo studio individuale Non sostituisce
Il trasporto del glucosio
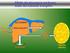 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Modulo 14 Il ciclo di Krebs
 Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Il metabolismo cellulare
 Il metabolismo cellulare 1 Il metabolismo cellulare CATABOLISMO Processo esoergonico (per produrre energia) Nutriliti NAD FAD NADP e - +H + ANABOLISMO Processo endoergonico Biopolimeri (x es. proteine)
Il metabolismo cellulare 1 Il metabolismo cellulare CATABOLISMO Processo esoergonico (per produrre energia) Nutriliti NAD FAD NADP e - +H + ANABOLISMO Processo endoergonico Biopolimeri (x es. proteine)
NADH FADH 2 (trasportatori ridotti di elettroni) Catena respiratoria (trasferimento degli
 NADH FADH 2 (trasportatori ridotti di elettroni) Fase 3 Trasferimento degli elettroni e fosforilazione ossidativa Catena respiratoria (trasferimento degli elettroni) Nicotinamide adenin dinucleotide (NAD
NADH FADH 2 (trasportatori ridotti di elettroni) Fase 3 Trasferimento degli elettroni e fosforilazione ossidativa Catena respiratoria (trasferimento degli elettroni) Nicotinamide adenin dinucleotide (NAD
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
CINETICA ENZIMATICA - velocità di reazione
 [P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
[P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
Introduzione allo studio del metabolismo Parte I
 Introduzione allo studio del metabolismo Parte I FOTOTROFI Le piante ed alcuni tipi di batteri ricavano l energia libera dal Sole mediante la fotosintesi, un processo in cui l energia luminosa è convertita
Introduzione allo studio del metabolismo Parte I FOTOTROFI Le piante ed alcuni tipi di batteri ricavano l energia libera dal Sole mediante la fotosintesi, un processo in cui l energia luminosa è convertita
prodotto finale della glicolisi
 Piruvato: prodotto finale della glicolisi Può andare incontro a vari destini: -in condizioni anaerobie: il piruvato viene ridotto a lattato (fermentazione lattica) o ad etanolo (fermentazione alcolica)
Piruvato: prodotto finale della glicolisi Può andare incontro a vari destini: -in condizioni anaerobie: il piruvato viene ridotto a lattato (fermentazione lattica) o ad etanolo (fermentazione alcolica)
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Lattato. Glicolisi. Piruvato
 Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
IL METABOLISMO. Dal carbonio agli OGM Capitolo 2
 IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
NADH e NADPH. ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente)
 NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
I Mitocondri Centrale elettrica cellulare
 I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
catalizzatori biologici RUOLO DEGLI ENZIMI: 16/03/15
 I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
Cap.16 GLICOLISI. Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP H 2 O 2 NAD + 2 NADH + 2H +
 Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Metabolismo del glucosio
 Metabolismo del glucosio Metabolismo del glucosio La glicolisi avviene in tutte le cellule umane Percorsi metabolici del glucosio in varie cellule: è metabolizzato in modo diverso nelle varie cellule TABELLA
Metabolismo del glucosio Metabolismo del glucosio La glicolisi avviene in tutte le cellule umane Percorsi metabolici del glucosio in varie cellule: è metabolizzato in modo diverso nelle varie cellule TABELLA
Coenzimi. Ioni essenziali. Molti coenzimi hanno come precursori le vitamine.
 COENZIMI Molti enzimi richiedono l associazione con particolari COFATTORI per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
COENZIMI Molti enzimi richiedono l associazione con particolari COFATTORI per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
Variazioni di energia libera nella glicolisi
 Variazioni di energia libera nella glicolisi 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio
Variazioni di energia libera nella glicolisi 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio
Fosforilazione a livello del substrato
 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Funzione catalitica delle proteine. Enzimi
 Funzione catalitica delle proteine Enzimi Gli enzimi sono proteine che fungono da catalizzatori delle reazioni chimiche che avvengono nei sistemi biologici concentrazione In una reazione chimica i reagenti
Funzione catalitica delle proteine Enzimi Gli enzimi sono proteine che fungono da catalizzatori delle reazioni chimiche che avvengono nei sistemi biologici concentrazione In una reazione chimica i reagenti
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
Introduzione al metabolismo
 Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
FADH ADP + Pi ATP...29 AG ' = -30,5 kj/mol...29 Resa di ATP per l ossidazione completa del glucosio...31
 FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
metano alcool metilico formaldeide acido formico CO 2
 -4-2 0 +2 +4 metano alcool metilico formaldeide acido formico CO 2 + ridotto + ossidato + ossidato Glicolisi 2 Glucosio Piruvato Glicolisi Glucosio + 2NAD + 2 piruvato + 2NADH + 2H + ΔG = -146 kj/mol 2ADP
-4-2 0 +2 +4 metano alcool metilico formaldeide acido formico CO 2 + ridotto + ossidato + ossidato Glicolisi 2 Glucosio Piruvato Glicolisi Glucosio + 2NAD + 2 piruvato + 2NADH + 2H + ΔG = -146 kj/mol 2ADP
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche I CATALIZZATORI ABBASSANO L ENERGIA DI ATTIVAZIONE FACILITANDO LA FORMAZIONE DELLO STATO DI TRANSIZIONE Il legame tra enzima e substrato genera un percorso
ENZIMI Catalizzatori delle reazioni biologiche I CATALIZZATORI ABBASSANO L ENERGIA DI ATTIVAZIONE FACILITANDO LA FORMAZIONE DELLO STATO DI TRANSIZIONE Il legame tra enzima e substrato genera un percorso
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Regolazione del Ciclo di Krebs 8 reazioni
 Regolazione del Ciclo di Krebs 8 reazioni Stechiometria del Ciclo Acetil-CoA + 3NAD + + FAD + GDP + Pi + 2H 2 O 2 CO 2 + HS-CoA + 3NADH + 2H + + FADH2 + GTP (GTP ATP) 1 NADH 2,5 ATP 1 FADH 2 1,5 ATP Per
Regolazione del Ciclo di Krebs 8 reazioni Stechiometria del Ciclo Acetil-CoA + 3NAD + + FAD + GDP + Pi + 2H 2 O 2 CO 2 + HS-CoA + 3NADH + 2H + + FADH2 + GTP (GTP ATP) 1 NADH 2,5 ATP 1 FADH 2 1,5 ATP Per
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la
 Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
La classificazione delle proteine
 protidi 1 La classificazione delle proteine In base al valore biologico (ovvero al contenuto di AAE) si distinguono: - p. ad alto valore biologico contengono tutti gli AAE (es. carne, pesce, uova, latte
protidi 1 La classificazione delle proteine In base al valore biologico (ovvero al contenuto di AAE) si distinguono: - p. ad alto valore biologico contengono tutti gli AAE (es. carne, pesce, uova, latte
Fosforilazione a livello del substrato
 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
La cinetica enzimatica
 La cinetica enzimatica Cinetica chimica All equilibrio Ordine di reazione I ordine II ordine Ordine zero La cinetica di una reazione chimica Cinetica di una reazione enzimatica Ordine 1 (enzima costante)
La cinetica enzimatica Cinetica chimica All equilibrio Ordine di reazione I ordine II ordine Ordine zero La cinetica di una reazione chimica Cinetica di una reazione enzimatica Ordine 1 (enzima costante)
