Analisi e purificazione di proteine
|
|
|
- Carlotta Cavalli
- 7 anni fa
- Visualizzazioni
Transcript
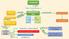
1 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione
2 Elettrofores i macromolecole cariche migrano in un campo elettrico in solvente non conducente con velocità ZeE u= η Z: numero di cariche per molecola e: 1.6x10-19C E: campo elettrico (volt/cm) η: coefficiente di attrito
3 µ= u E Mobilità elettroforetica LogM = a bx M: peso molecolare x: distanza percorsa nel gel Log M Elettroforesi su gel x gel sopprime le correnti convettive provocate da gradienti di temperatura funziona da setaccio molecolare
4 Condizioni denaturanti La miscela di proteine viene disciolta in: Sodio Dodecil Solfato (SDS) * + mercaptoetanolo [HS-CH2-CH2-OH]** 1 SDS / 2 residui amino acidici si legano alla catena principale carica negativa netta massa della proteina carica proteina-sds>>carica proteina nativa *Detergente anionico che spezza i legami non covalenti ** Riduce i ponti disolfuro
5 Figure 8-17 Molecular Biology of the Cell ( Garland Science 2008)
6 Figure 8-18a Molecular Biology of the Cell ( Garland Science 2008)
7 Elettroforesi su gel di poliacrilamide i gel di poliacrilamide sono chimicamente inerti varie dimensioni dei pori setaccio molecolare migliora l efficienza dell elettroforesi
8 Figure 8-18b Molecular Biology of the Cell ( Garland Science 2008)
9 Figure 8-19 Molecular Biology of the Cell ( Garland Science 2008)
10 Figure 8-20 Molecular Biology of the Cell ( Garland Science 2008)
11 Figure 8-20a Molecular Biology of the Cell ( Garland Science 2008)
12 Figure 8-20b Molecular Biology of the Cell ( Garland Science 2008)
13 Figure 8-21 Molecular Biology of the Cell ( Garland Science 2008)
14 Figure 8-22 Molecular Biology of the Cell ( Garland Science 2008)
15 colorazione con argento o con blu Coomassie 1 dalton = 1/12 massa del 12C = Kg amu : unità di massa atomica = massa del protone 1 amu = Kg
16 Sensibilità del metodo Blu Coomassie bande contenenti 0.1 µg di proteina argento bande contenenti 0.02 µg di proteina Si possono distinguere proteine che differiscono in massa di circa il 2% A: 40 kd circa 10 residui di differenza B: 41 kd
17 Focalizzazione isoelettrica pi = punto Isolelettrico = ph a cui la carica netta è zero citocromo C albumina pi = 10.6 pi = 4.8 elettroforesi in gradiente di ph (senza SDS) si possono separare proteine che differiscono tra loro di una sola carica
18 focalizzazione isoelettrica + elettroforesi su gel con SDS 1. focalizzazione isoelettrica elettroforesi orizzontale 2. gel con SDS elettroforesi orizzontale Massa macchie su 2 dimensioni Proteine di E.coli sono state separate > 1000 proteine in un singolo esperimento pi
19 Figure 8-23 Molecular Biology of the Cell ( Garland Science 2008)
20 Purificazione di proteine nella loro forma nativa (struttura 3D intatta) si sfruttano 1. dimensioni 2. solubilità 3. carica 4. affinità con molecole specifiche test per l attività catalitica test per la purezza (SDS)
21 1. Separazione mediante dialisi separazione delle proteine da molecole molto più piccole
22 1. Gel-cromatografia = cromatografia per filtrazione su gel insolubile, ma altamente idratato le molecole più piccole entrano nei granuli e le grandi no le grandi passano più velocemente
23 raccogliendo in tempi diversi all uscita della colonna si possono separare proteine di dimensioni diverse e con diversa solubilità
24 3. Cromatografia a scambio ionico ph=7 carica netta positiva attacco a COOcarica netta negativa nessuna interazione
25 4. Cromatografia di affinità esempio: Concanavalina A alta affinità per il glucosio colonna con glucosio la proteina si attacca il resto scorre aggiunta di glucosio liberazione della proteina G G proteina colonna G aggiunta glucosio colonna G proteina G G
26 Ultra-centrifugazione refrigerazione campione sedimentato vuoto motore
27 Fc = m ω 2r = m(1 v ρ )ω 2r v : volume specifico della proteina ρ : densità della soluzione fattore di galleggiamento v = velocità di sedimen. = costante = Fc m(1 v ρ )ω 2 r = = f f f : coeff. frizionale della proteina s = coeff. di sediment. [s] = Svedberg (S) m(1 v ρ = = 2 f ω r v 1S = sec )
28 Velocità di sedimentazione massa (a parità di forma e densità) (densità della molecola)-1 funzione (complicata) della forma (f ) funzione della densità della soluzione (ρ) vρ < 1 vρ = 1 vρ > 1 galleggiamento immobilità affondamento
29 Lisosomi Batteri Virus mosaico tabacco (4x104 kd) Ribosoma E.coli (2500 kd) RNA ribosomale (1100 kd) Fibrinogeno (330 kd) Emoglobina (68 kd) Ribonucleasi A (12.4 kd) La centrifugazione può essere usata per separare molecole con diversi coefficienti di sedimentazione 104 S
30 Esempio Molecola anticorpale: PM = 150 kd Ultracentrifuga: r = 8 cm, rivoluzioni/ min (rpm) Accelerazione centrifuga: 4.9 x 108 cm/s2 5 x 105 g se v (proteina) = 3.4 x 10-4 cm/s allora s = 7S
31 Sedimentazione all equilibrio Peso Molecolare (PM) centrifugazione a bassa velocità gradiente di concentrazione (sedimentazione bilanciata dalla diffusione) 2kT c2 m= ln (1 v ρ )ω c1 (r2 r1 ) m: massa proteina ci : concentrazioni a distanza ri dall asse di rotazione k: costante di Boltzmann T: temperatura
32 Sequenziamento per mezzo della degradazione di Edman concentrazione aa i. Ala-Gly-Asp-Phe-Arg-Gly scaldando a 110ºC in HCl 6N per 24 ore composizione in a.a. Asp: catena laterale acida: primo aa ad uscire si può individuare fino a 1 µg di un aa (=quantità presente in un impronta digitale) cromatografia a scambio ionico eluzione in funzione del ph
33 ii. identificazione del residuo amino terminale (a) marcatura con cloruro di dansile idrolisi può essere usato 1 sola volta (degradazione completa del peptide) (b) degradazione di Edman: rimozione di un a.a. alla volta dall estremità amino-terminale
34 Passi del sequenziamento a. b. c. d. e. f. composizione in a.a. rimozione alla Edman composizione in a.a. rimozione alla Edman composizione in a.a. e così via a-c Ala c-e Gly e così via 1Ala, 2Gly, 1Asp, 1Phe, 1Arg 2Gly, 1Asp, 1Phe, 1Arg 1Gly, 1Asp, 1Phe, 1Arg
35 Metodo di Edman Lunghezza massima 50 resisui perdita di attendibilità Tagli specifici con metodi chimici o enzimatici Reagente Taglio chimico Bromuro di cianogeno O-iodobenzoato Idrossilamina 2-Nitro-5-tiocianobenzoato Taglio enzimatico Tripsina Clostripaina Proteasi dello Stafilococco Sito di taglio Lato carbossilico di residui Met Lato carbossilico di residui Trp Legami Asp-Gly Lato aminico di residui di Cis Lato carbossilico di residui Lys e Arg Lato carbossilico di residui Arg Lato carbossilico di residui Asn e Gln
36 Prima proteina sequenziata Sanger F., Tuppy H. (1951) The amino-acid sequence in the phenylalanyl chain of insulin 2. The investigation of peptides from enzymic hydrolysates. Biochem. J. 49: Si dimostró che la sequenza era costituita solo da L-aminoacidi uniti tra loro da legami peptidici fra i gruppi α-aminici e i gruppi α-carbossilici metodo costoso ed inefficiente DNA ricombinante
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Metodi per il sequenziamento di proteine
 Metodi per il sequenziamento di proteine Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto
Metodi per il sequenziamento di proteine Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto
PURIFICAZIONE DELLE PROTEINE
 PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Centrifugazione. Alle sospensioni viene applicato un campo gravitazionale artificiale attraverso la rotazione ad alta velocità (campo centrifugo).
 Centrifugazione Alle sospensioni viene applicato un campo gravitazionale artificiale attraverso la rotazione ad alta velocità (campo centrifugo). Viene sfruttata la differenza di densità tra le particelle
Centrifugazione Alle sospensioni viene applicato un campo gravitazionale artificiale attraverso la rotazione ad alta velocità (campo centrifugo). Viene sfruttata la differenza di densità tra le particelle
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Acidi nucleici come materiale di studio. DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna
 Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA
 TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA TIPI DI CENTRIFUGHE CENTRIFUGHE PREPARATIVE Consentono la separazione, isolamento e purificazione
TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA TIPI DI CENTRIFUGHE CENTRIFUGHE PREPARATIVE Consentono la separazione, isolamento e purificazione
TECNICHE CENTRIFUGATIVE
 TECNICHE CENTRIFUGATIVE Le tecniche di separazione mediante centrifugazione sfruttano il comportamento delle particelle all interno di un campo centrifugo applicato Lo scopo di tali metodiche e quello
TECNICHE CENTRIFUGATIVE Le tecniche di separazione mediante centrifugazione sfruttano il comportamento delle particelle all interno di un campo centrifugo applicato Lo scopo di tali metodiche e quello
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea
 la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
La struttura covalente delle proteine (la sequenza amminoacidica)
 La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Metodi di studio delle proteine (o altre macromolecole)
 Metodi di studio delle proteine (o altre macromolecole) Purificazione Separazione da altri componenti cellulari; determinazione del grado di purezza Studio Determinazione della struttura funzione regolazione
Metodi di studio delle proteine (o altre macromolecole) Purificazione Separazione da altri componenti cellulari; determinazione del grado di purezza Studio Determinazione della struttura funzione regolazione
Never impure protein PURIFICAZIONE DI PROTEINE
 Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
TIPI di CROMATOGRAFIA
 Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
TECNICHE ELETTROFORETICHE
 TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Distribuzione AA in banca dati
 Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Strategia generale per la purificazione: metodi di frazionamento.
 Strategia generale per la purificazione: metodi di frazionamento. - Il fatto che le proteine fossero sostanze chimiche ben definite non venne accettato per intero finché James Sumner nel 1926 cristallizzò
Strategia generale per la purificazione: metodi di frazionamento. - Il fatto che le proteine fossero sostanze chimiche ben definite non venne accettato per intero finché James Sumner nel 1926 cristallizzò
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
METODI BIOCHIMICI ESERCIZI D ESAME (by NewSgrunt)
 METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa
 WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
Struttura secondaria
 Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
FOCALIZZAZIONE ISOELETTRICA (IEF)
 FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Tecniche Centrifugative
 Tecniche Centrifugative Metodologie Biochimiche 29 Novembre 2015 Il materiale contenuto in queste diapositive è ad esclusivo uso didattico per l università di Teramo Centrifugazione Permette la separazione
Tecniche Centrifugative Metodologie Biochimiche 29 Novembre 2015 Il materiale contenuto in queste diapositive è ad esclusivo uso didattico per l università di Teramo Centrifugazione Permette la separazione
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina 3500 V catod o
 La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
mediante proteasi industriali
 Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
WESTERN BLOT o IMMUNOFISSAZIONE
 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
OGRAMMA DI CHIMICA 2016
 ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
Analisi quantitativa dell interazione proteina-proteina
 Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
I RECETTORI: Caratterizzazione e isolamento
 I RECETTORI: Caratterizzazione e isolamento Andrea Ferrigno Funzione dei recettori di membrana Secrezione dell ormone nel sangue L ormone è trasportato attraverso il circolo sanguigno L ormone raggiunge
I RECETTORI: Caratterizzazione e isolamento Andrea Ferrigno Funzione dei recettori di membrana Secrezione dell ormone nel sangue L ormone è trasportato attraverso il circolo sanguigno L ormone raggiunge
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Primo Levi Il sistema periodico
 Primo Levi Il sistema periodico L anidride carbonica [...] questo gas che costituisce la materia prima della vita, la scorta permanente a cui tutto ciò che cresce attinge, e il destino ultimo di ogni carne,
Primo Levi Il sistema periodico L anidride carbonica [...] questo gas che costituisce la materia prima della vita, la scorta permanente a cui tutto ciò che cresce attinge, e il destino ultimo di ogni carne,
2. LA PURIFICAZIONE DI PROTEINE:
 2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Applicazione equazione di Bernoulli: stenosi arteriosa(restringimento arteria)
 Applicazione equazione di Bernoulli: stenosi arteriosa(restringimento arteria) Applicazione equazione di Bernoulli: Aneurisma (dilatazione arteria) Liquidi reali attrito interno-viscosita' la velocita'
Applicazione equazione di Bernoulli: stenosi arteriosa(restringimento arteria) Applicazione equazione di Bernoulli: Aneurisma (dilatazione arteria) Liquidi reali attrito interno-viscosita' la velocita'
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
TRASCRIZIONE e TRADUZIONE
 TRASCRIZIONE e TRADUZIONE Trascrizione e traduzione Dogma centrale della biologia molecolare: processo con cui l informazione contenuta nel DNA dirige la sintesi delle proteine. Trascrizione Maturazione
TRASCRIZIONE e TRADUZIONE Trascrizione e traduzione Dogma centrale della biologia molecolare: processo con cui l informazione contenuta nel DNA dirige la sintesi delle proteine. Trascrizione Maturazione
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
CARATTERIZZAZIONE DELLE INTERAZIONI
 CARATTERIZZAZIONE DELLE INTERAZIONI Costante di legame Concentrazione delle due specie Interazione Competizione con altre proteine Cofattori Compartimentazione cellulare Fattori che influenzano l interazione
CARATTERIZZAZIONE DELLE INTERAZIONI Costante di legame Concentrazione delle due specie Interazione Competizione con altre proteine Cofattori Compartimentazione cellulare Fattori che influenzano l interazione
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
concentrazione finale rispettivamente di 0.2 M e?%,a 55.c 60 minuti.
 SEPARAZIONE DELLE SUBUNITA' DELLA RIBULOSIO-1,5-DIFOSFATO CARBOSSILASI DA FOGLIE DI CARCIOFO. Cardinali A.,Miceli A.,Pacoda D. e Gallerani R. Centro di Biologia,Laboratorio di Chimica Biologica,Universita'
SEPARAZIONE DELLE SUBUNITA' DELLA RIBULOSIO-1,5-DIFOSFATO CARBOSSILASI DA FOGLIE DI CARCIOFO. Cardinali A.,Miceli A.,Pacoda D. e Gallerani R. Centro di Biologia,Laboratorio di Chimica Biologica,Universita'
Biologia Molecolare. CDLM in CTF La trascrizione negli eucarioti
 Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA).
 Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
FENOMENI! di! TRASPORTO!
 FENOMENI! di! TRASPORTO! - SPINTA DI ARCHIMEDE - TRASPORTO IN REGIME VISCOSO - SEDIMENTAZIONE - MOTO CIRCOLARE UNIFORME - CENTRIFUGAZIONE - ELETTROFORESI Lucidi del Pro. D. Scannicchio orza SPINTA di ARCHIMEDE
FENOMENI! di! TRASPORTO! - SPINTA DI ARCHIMEDE - TRASPORTO IN REGIME VISCOSO - SEDIMENTAZIONE - MOTO CIRCOLARE UNIFORME - CENTRIFUGAZIONE - ELETTROFORESI Lucidi del Pro. D. Scannicchio orza SPINTA di ARCHIMEDE
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE
 MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
STRUTTURAZIONE DELLE PROTEINE
 STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
1. Cromatografia per gel-filtrazione
 1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
Racemizzazione degli amminoacidi
 Racemizzazione degli amminoacidi Gli amminoacidi hanno (quasi) tutti la chiralità L e sono otticamente attivi: la luce polarizzata che attraversa una soluzione otticamente attiva ruota la sua polarizzazione
Racemizzazione degli amminoacidi Gli amminoacidi hanno (quasi) tutti la chiralità L e sono otticamente attivi: la luce polarizzata che attraversa una soluzione otticamente attiva ruota la sua polarizzazione
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Polymerase chain reaction - PCR. Biotecnologie applicate all ispezione degli alimenti di origine animale
 Prof.ssa Tiziana Pepe Polymerase chain reaction - PCR Biotecnologie applicate all ispezione degli alimenti di origine animale Dip. di Medicina Veterinaria e Produzioni animali tiziana.pepe@unina.it Metodologia
Prof.ssa Tiziana Pepe Polymerase chain reaction - PCR Biotecnologie applicate all ispezione degli alimenti di origine animale Dip. di Medicina Veterinaria e Produzioni animali tiziana.pepe@unina.it Metodologia
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
IL SEQUENZIAMENTO DEL DNA. Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA.
 IL SEQUENZIAMENTO DEL DNA Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA. Il DNA può essere sequenziato generando frammenti di DNA la cui lunghezza dipende dall ultima base della sequenza.
IL SEQUENZIAMENTO DEL DNA Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA. Il DNA può essere sequenziato generando frammenti di DNA la cui lunghezza dipende dall ultima base della sequenza.
Composizione della sostanza azotata del latte vaccino (% rel)
 Composizione della sostanza azotata del latte vaccino (% rel) s1 29-35 Caseine s2 8-10 35-40 78 10-15 Materia Azotata Proteica ( ) lattoglobulina 4-8 8-9 94-95 Materia Azotata Totale (N*6,38) Proteine
Composizione della sostanza azotata del latte vaccino (% rel) s1 29-35 Caseine s2 8-10 35-40 78 10-15 Materia Azotata Proteica ( ) lattoglobulina 4-8 8-9 94-95 Materia Azotata Totale (N*6,38) Proteine
Macromolecole Biologiche Interazioni non covalenti
 Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
LEGGE DI STOKES. Fisica Applicata, Area Infermieristica, M. Ruspa
 LEGGE DI STOKES La forza di attrito viscoso che agisce su un corpo sfrerico di raggio r che si muove con velocita v non elevata in un fluido di viscosita η in quite si puo calcolare come: SEDIMENTAZIONE
LEGGE DI STOKES La forza di attrito viscoso che agisce su un corpo sfrerico di raggio r che si muove con velocita v non elevata in un fluido di viscosita η in quite si puo calcolare come: SEDIMENTAZIONE
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
