Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
|
|
|
- Battista Salvatore
- 7 anni fa
- Visualizzazioni
Transcript
1 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo
2 Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle proteine è essenziale per comprendere i loro meccanismi di azione 2. Il confronto fra le sequenze di proteine analoghe ha permesso di comprendere il funzionamento delle proteine e ha indicato collegamenti evoluzionistici fra le proteine e gli organismi che le producono 3. L analisi della sequenza amminoacidica ha portato ad importanti applicazioni cliniche poiché molte malattie sono causate da mutazioni legate ad un cambiamento amminoacidico nella sequenza proteica
3 1. Preliminari a. Denaturazione delle proteine b. Riduzione e alchilazione dei ponti disolfuro c. Determinazione delle subunità 2. Analisi dei segmenti a. Frammentare le subunità in peptidi b. Degradazione di Edman 3. Ricostruzione della sequenza a. Allineamento di sequenze b. Assegnazione disolfuri
4 1. Preliminari a. Denaturazione delle proteine Le proteine vengono denaturate in condizioni acide o basiche, a bassa concentrazione salina, a elevate temperature oppure usando agenti denaturanti come l UREA e lo ione guanidinio o detergenti come l SDS.
5 b. Riduzione e alchilazione dei ponti disolfuro Serve per prevenire la conformazione nativa della proteina che può ostruire l azione degli agenti proteolitici usati nella determinazione della struttura primaria Agente riducente: Agente riducente: -2-mercaptoetanolo -ditiotreitolo -ditioeritritolo
6 Reazione di riduzione dei ponti disolfuro con 2-mercaptoetanolo H S S NH H + 2 HS H2 H NH H SH NH + HS H + H S S H NH
7 Agente alchilante: -acido iodioacetico Reazione di alchilazione delle cisteine H SH + I - H S - + HI NH NH
8 c. Determinazione delle subunità L identificazione dei residui N- e - terminali permette di stabilire il numero di subunità (catene polipeptidiche) da cui è costituita una proteina. Identificazione del residuo N-terminale: - dansil cloruro
9 Separazione, purificazione e caratterizzazione delle subunità Se una proteina risulta costituita da più subunità, queste devono essere separate usando i metodi di purificazione quali IE, GF, ecc. e caratterizzate mediante SDS-PAGE o spettrometria di massa per stabilirne il peso molecolare
10 Identificazione del residuo -terminale: Non esistono procedure paragonabili a quelle della determinazione del residuo N-terminale. Esistono enzimi che tagliano al -terminale, come le carbossipeptidasi. Le carbossipeptidasi tagliano al -terminale con una velocità che dipende dal tipo di amminoacido e che è indipendente dalla posizione dell amminoacido nella sequenza. Esistono metodi chimici per identificare i residui -terminali, quali l idrazinolisi, mediante l uso di idrazina. Tale processo è però soggetto a molte reazioni secondarie.
11 2. Analisi dei segmenti a. Frammentare le subunità in peptidi iascuna subunità può essere frammentata in peptidi sia enzimaticamente sia chimicamente. In entrambe i casi il processo di cleavage deve essere completo e altamente specifico in modo tale che la sequenza dei frammenti peptidici, quando correttamente riordinati, è quella della subunità intatta.
12 leavage con Tripsina Reazione di cleavage con Tripsina N Lys (or Arg) N L RP HPL è diventata la procedura di routine per la separazione di peptidi. Tripsina H N H H N H H N H - + +H 3 N H R R
13 Frammentazione con NBr Met H 3 H 3 S Br N Br - + S N H N H H N H HN H HN H R R H 3 H N H + Peptidil omoserina lattone H N H S + N Metiltiocianato + H 3 N 3 H N H R R
14 b. Degradazione di Edman Una volta ottenuti frammenti peptidici manegevoli, la sequenza amminoacidica può essere determinata mediante cicli ripetuti della degradazione di Edman RP HPL UV detector Possono essere identificati residui N-terminali di peptidi lunghi fino a amminoacidi prima che gli effetti di reazioni incomplete, di reazioni non specifiche e di perdita di peptidi facciano si che l identificazione amminoacidica non possa essere completabile.
15 1. Il reagente di Edman, fenilisotiocianato (PIT), reagisce con il gruppo amminico N-terminale di un polipeptide in condizioni blandamente alcaline, per formare il feniltiocarbamile (PT) 2. Tale addotto è trattato con acido trifluoroacetico (F 3 H) anidro, che libera il residuo N-terminale sotto forma di derivato tiazolinonico, senza idrolizzare gli altri legami peptidici 3. Il derivato tiazolinone-amminoacido amminoacido è estratto selettivamente con un solvente organico ed è convertito nel più stabile derivato feniltioidantoina (PTH) mediante trattamento con un acido in soluzione acquosa
16 Identificazione del PTH-aa N-terminale mediante cromatografia Il tipo di amminoacido è identificato con una cromatografia per mezzo di amminoacidi standard di riferimento
17 3. Ricostruzione della sequenza a. Allineamento di sequenze L allineamento di sequenza viene fatto mettendo a confronto le sequenze amminoacidiche di un set di frammenti peptidici con quelli di un secondo set i cui siti di cleavage si sovrappongono con quelli del primo set. La proteina viene ridotta prima del cleavage! Ad es. Primo set di peptidi ottenuti con Tripsina (che taglia Lys/Arg al terminale) Secondo set di peptidi ottenuto con NBr (che taglia Met al terminale)
18 Determinazione del segmento -terminale
19 Ricostruzione della sequenza M
20 Sequenza finale
21 b. Assegnazione disolfuri Lo step finale nell analisi della sequenza amminoacidica è quello di determinare la posizione dei ponti disolfuro. Si taglia la proteina (ad es. con Tripsina) in forma nativa non ridotta per mantenere intatti i ponti disolfuro A B
22 Separiamo i peptidi ( A e B) mediante HPL Determiniamo le sequenze N-terminali di ciascun peptide?
23 Si determina, mediante la conoscenza della sequenza amminoacidica, in quale peptide ci sono due isteine e si sceglie una seconda proteasi (o NBr) che taglia in due il peptide contenente le due cisteine
24 Struttura finale della proteina con i ponti disolfuro SequencingMaster.swf
La struttura covalente delle proteine (la sequenza amminoacidica)
 La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 14
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 14 Caratterizzazione strutturale delle proteine Concetti chiave: Per poter essere sequenziata, una proteina deve essere separata
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 14 Caratterizzazione strutturale delle proteine Concetti chiave: Per poter essere sequenziata, una proteina deve essere separata
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
LE PROTEINE -struttura tridimensionale-
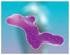 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Distribuzione AA in banca dati
 Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
SINTESI PEPTIDICA LEZIONE 4
 SINTESI PEPTIDICA LEZIONE 4 PEPTIDI I legami peptidici sono legami ammidici che uniscono i residui amminoacidici. gruppo ammino libero a sx gruppo carbossilico libero a dx configurazione trans più stabile
SINTESI PEPTIDICA LEZIONE 4 PEPTIDI I legami peptidici sono legami ammidici che uniscono i residui amminoacidici. gruppo ammino libero a sx gruppo carbossilico libero a dx configurazione trans più stabile
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
IL DOGMA CENTRALE DELLA BIOLOGIA RNA
 La traduzione IL DOGMA CENTRALE DELLA BIOLOGIA Trascrizione DNA Passaggio dell informazione contenuta nel DNA mediante la sintesi di RNA RNA Proteine Duplicazione DNA Traduzione Costruzione della catena
La traduzione IL DOGMA CENTRALE DELLA BIOLOGIA Trascrizione DNA Passaggio dell informazione contenuta nel DNA mediante la sintesi di RNA RNA Proteine Duplicazione DNA Traduzione Costruzione della catena
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
Le molecole biologiche. Le proteine
 Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Spettrometria di Massa applicata alla PROTEOMICA
 Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Ø Gel Elettroforesi (GE) Ø Spettrometria di Massa (MS)
 Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Composti organici dello zolfo
 Complementi di Chimica rganica Composti organici dello zolfo He B C e i P Cl Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 4 3d 0 Lo zolfo è un elemento della seconda riga della tavole periodica, è più grande, meno
Complementi di Chimica rganica Composti organici dello zolfo He B C e i P Cl Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 4 3d 0 Lo zolfo è un elemento della seconda riga della tavole periodica, è più grande, meno
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Depilazione-calcinazione
 Depilazione-calcinazione 1 Scopo della lavorazione La depilazione serve per eliminare dalla pelle il pelo e lo strato di epidermide (formato anch esso da cheratine) che per sua natura chimica non sarebbe
Depilazione-calcinazione 1 Scopo della lavorazione La depilazione serve per eliminare dalla pelle il pelo e lo strato di epidermide (formato anch esso da cheratine) che per sua natura chimica non sarebbe
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
MS e Biomolecole FOLDING PROTEICO. Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE
 MS e Biomolecole Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione del peso molecolare Individuazione di isoforme Mappatura peptidica e conferma della struttura
MS e Biomolecole Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione del peso molecolare Individuazione di isoforme Mappatura peptidica e conferma della struttura
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
MS e Biomolecole FOLDING PROTEICO. Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE
 MS e Biomolecole Teoria e applicazioni Spettro ESI-MS della transferrina, una proteina ad alto peso molecolare (circa 80000Da). APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione
MS e Biomolecole Teoria e applicazioni Spettro ESI-MS della transferrina, una proteina ad alto peso molecolare (circa 80000Da). APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA
 TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA TRADUZIONE La traduzione e il processo con cui viene sintetizzata un data proteina, attraverso reazioni chimiche di polimerizzazione di amminoacidi, in una
TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA TRADUZIONE La traduzione e il processo con cui viene sintetizzata un data proteina, attraverso reazioni chimiche di polimerizzazione di amminoacidi, in una
La struttura delle proteine viene suddivisa in quattro livelli di organizzazione:
 Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Acquisizione e Stabilità della struttura terziaria delle proteine
 Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
I RECETTORI: Caratterizzazione e isolamento
 I RECETTORI: Caratterizzazione e isolamento Andrea Ferrigno Funzione dei recettori di membrana Secrezione dell ormone nel sangue L ormone è trasportato attraverso il circolo sanguigno L ormone raggiunge
I RECETTORI: Caratterizzazione e isolamento Andrea Ferrigno Funzione dei recettori di membrana Secrezione dell ormone nel sangue L ormone è trasportato attraverso il circolo sanguigno L ormone raggiunge
30/10/2015. Molte proteine sono. intrinsecamente disordinate. o destrutturate (IDP/IUP), cioè non hanno una struttura
 Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
INTRODUZIONE. Negli ultimi anni lo sviluppo di metodi avanzati per il sequenziamento
 INTRODUZIONE La proteomica Negli ultimi anni lo sviluppo di metodi avanzati per il sequenziamento del DNA, ha contribuito in modo notevole alla caratterizzazione e all ottenimento del genoma completo di
INTRODUZIONE La proteomica Negli ultimi anni lo sviluppo di metodi avanzati per il sequenziamento del DNA, ha contribuito in modo notevole alla caratterizzazione e all ottenimento del genoma completo di
La microcalorimetria differenziale a scansione (DSC). Applicazioni nello studio della termostabilità delle proteine
 La microcalorimetria differenziale a scansione (DSC). Applicazioni nello studio della termostabilità delle proteine Applicazioni della DSC allo studio di macromolecole biologiche Analisi dei parametri
La microcalorimetria differenziale a scansione (DSC). Applicazioni nello studio della termostabilità delle proteine Applicazioni della DSC allo studio di macromolecole biologiche Analisi dei parametri
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
 SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
CAPITOLO 2 STUDIO DELLA STRUTTURA PRIMARIA DELLE PROTEINE
 CAPITOLO 2 STUDIO DELLA STRUTTURA PRIMARIA DELLE PROTEINE Analisi della composizione amminoacidica delle proteine La determinazione della composizione amminoacidica di una proteina permette di sapere da
CAPITOLO 2 STUDIO DELLA STRUTTURA PRIMARIA DELLE PROTEINE Analisi della composizione amminoacidica delle proteine La determinazione della composizione amminoacidica di una proteina permette di sapere da
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
Esercizi sui Bilanci di Massa
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
AGR- VET 18 - IL PROSCIUTTO CRUDO
 AGR- VET 18 - IL PROSCIUTTO CRUDO docente Patrizia Cattaneo Bibliografia: C. Cantoni, S. d Aubert: Il prosciutto San Daniele. Eurocarni, Parti I, II, III: 1987, 5, 46-61; 6, 52-55; 7, 52-57 Prosciutto
AGR- VET 18 - IL PROSCIUTTO CRUDO docente Patrizia Cattaneo Bibliografia: C. Cantoni, S. d Aubert: Il prosciutto San Daniele. Eurocarni, Parti I, II, III: 1987, 5, 46-61; 6, 52-55; 7, 52-57 Prosciutto
LA TRADUZIONE E IL CODICE GENETICO
 LA TRADUZIONE E IL CODICE GENETICO La traduzione La traduzione è il processo di sintesi di una catena polipeptidica, un polimero costituito da amminoacidi legati insieme da legami peptidici Le molecole
LA TRADUZIONE E IL CODICE GENETICO La traduzione La traduzione è il processo di sintesi di una catena polipeptidica, un polimero costituito da amminoacidi legati insieme da legami peptidici Le molecole
Struttura esame Biochimica per Sc. Biologiche DM270 e DM509 da gennaio 2017
 Struttura esame Biochimica per Sc. Biologiche DM270 e DM509 da gennaio 2017 Prof. G. Gilardi : biomolecole, enzimi, vitamine Prof. S.J. Sadeghi : metabolismo ed esercitazioni Prof. G. Gilardi - Biological
Struttura esame Biochimica per Sc. Biologiche DM270 e DM509 da gennaio 2017 Prof. G. Gilardi : biomolecole, enzimi, vitamine Prof. S.J. Sadeghi : metabolismo ed esercitazioni Prof. G. Gilardi - Biological
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
La battaglia contro l influenza
 La battaglia contro l influenza Il contributo della biologia strutturale allo sviluppo di inibitori della sialidasi Prof. Elena Luraschi Virus dell influenza I virus dell influenza sono virus a RNA, con
La battaglia contro l influenza Il contributo della biologia strutturale allo sviluppo di inibitori della sialidasi Prof. Elena Luraschi Virus dell influenza I virus dell influenza sono virus a RNA, con
TRASCRIZIONE e TRADUZIONE
 TRASCRIZIONE e TRADUZIONE Trascrizione e traduzione Dogma centrale della biologia molecolare: processo con cui l informazione contenuta nel DNA dirige la sintesi delle proteine. Trascrizione Maturazione
TRASCRIZIONE e TRADUZIONE Trascrizione e traduzione Dogma centrale della biologia molecolare: processo con cui l informazione contenuta nel DNA dirige la sintesi delle proteine. Trascrizione Maturazione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Acidi Poliprotici. Si definiscono acidi poliprotici, le sostanze in grado di donare più di un protone all acqua:
 Acidi Poliprotici Si definiscono acidi poliprotici, le sostanze in grado di donare più di un protone all acqua: Esempi: Acido solforico H SO >> 1, a 1. x1 Acido carbonico H O.5x1 7, a.69 x1 11 Acido fosforico
Acidi Poliprotici Si definiscono acidi poliprotici, le sostanze in grado di donare più di un protone all acqua: Esempi: Acido solforico H SO >> 1, a 1. x1 Acido carbonico H O.5x1 7, a.69 x1 11 Acido fosforico
DEL DECRETO LEGISLATIVO 29 APRILE 2006, N. 217
 A LLEGATO MODIFICA DEGLI ALLEGATI 1, 6, 7 e 10 DEL DECRETO LEGISLATIVO 29 APRILE 2006, N. 217 E SUCCESSIVE MODIFICHE All Allegato 1, punto 1.11 è aggiunto il seguente testo: Estratto vegetale contenente
A LLEGATO MODIFICA DEGLI ALLEGATI 1, 6, 7 e 10 DEL DECRETO LEGISLATIVO 29 APRILE 2006, N. 217 E SUCCESSIVE MODIFICHE All Allegato 1, punto 1.11 è aggiunto il seguente testo: Estratto vegetale contenente
all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA
 Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
LEZIONI Temi e competenze acquisite Argomenti Contenuti specifici Ore 1. INTRODUZIONE AL CORSO Informazioni per gli studenti. Strutture cicliche dei
 Insegnamento: CHIMICA DELLE SOSTANZE NATURALI (cod. 069; 6 CFU; 60 ore) A.A. 04-05 Corso di laurea: Tecnologie Alimentari (TA) Scuola di Agraria e Medicina Veterinaria - Campus di Cesena Dott.ssa ELENA
Insegnamento: CHIMICA DELLE SOSTANZE NATURALI (cod. 069; 6 CFU; 60 ore) A.A. 04-05 Corso di laurea: Tecnologie Alimentari (TA) Scuola di Agraria e Medicina Veterinaria - Campus di Cesena Dott.ssa ELENA
circolare in ambito alimentare Alberto Barbiroli
 Principi ed applicazioni del dicroismo circolare in ambito alimentare Alberto Barbiroli Origine del segnale CD Luce polarizzata planarmente Il vettore campo elettrico oscilla su una linea Sovrapposizione
Principi ed applicazioni del dicroismo circolare in ambito alimentare Alberto Barbiroli Origine del segnale CD Luce polarizzata planarmente Il vettore campo elettrico oscilla su una linea Sovrapposizione
