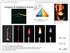
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
|
|
|
- Norberto Colella
- 5 anni fa
- Visualizzazioni
Transcript
1 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford ( ) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio)
2 Rutherford suppose che gli atomi fossero costituiti da grandi spazi vuoti e che tutta la massa dovesse essere concentrata in una zona piccolissima, carica positivamente, che chiamò nucleo. Volume nucleo = cm 3 Volume atomo = cm 3 La densità del nucleo è di ~10 11 kg/cm 3 equivalenti a Ton/mm 3!!
3 Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica: F = m a F centrifuga = m v r = Fm -1 (costante dielettrica del vuoto) q=q =e = carica elettrica elettrone [C] Quantizzazione del momento angolare (1) mvr = n h h= Jsec
4 Quantizzazione del raggio delle orbite e = m v r= e = e r r v m v m r () a) b) (3) r = n h 4 m e dove n = 1,, 3, 4,... Quantizzazione dell'energia Dalla () E = E + E = 1 mv - e cin. pot. r E = 1 e r E pot - e r F = - 1 dr e r F e r E n = - 1 m e 4 n (4) h dove n = 1,, 3, 4,.
5 Raggi delle orbite dei primi quattro stati quantici dell elettroneelettrone nell atomo di idrogeno secondo il modello di Bohr Livelli energetici dei primi stati quantici dell elettrone elettrone nell atomo di idrogeno secondo il modello di Bohr h rn n 4 π me r n E n r n n h E n1 1 π me E n
6 N. Bohr capì che l emissione di luce da parte degli atomi era legata agli elettroni, che ruotavano intorno al nucleo.
7 spettrometro
8 Per saltare da un orbita ad un altra di livello energetico più alto, l elettrone deve assorbire energia. Quando l elettrone cade su un livello di energia inferiore, l atomo emette una luce caratteristica (emette energia). L energia della luce emessa o assorbita è uguale alla differenza fra le energie delle due orbite.
9 Le onde Ampiezza; Distanza del massimo di una cresta dal livello corrispondente alla posizione di quiete. l = Lunghezza d onda; Distanza tra i due massimi di due creste consecutive ovvero tra due punti in fase. v=velocità; Spazio percorso da una cresta in un dato intervallo di tempo. n = frequenza; Numero di creste (n) che in un determinato intervallo di tempo (t) passano per un punto dato. Velocità della luce: c = = m s -1 ν C λ
10
11 Ogni radiazione può essere considerata come un insieme di numerosissime particelle, dette fotoni, ognuna con il suo determinato pacchetto di energia
12
13 Ogni atomo emette uno spettro caratteristico formato da una serie di righe Gli spettri atomici si possono usare come un impronta digitale per riconoscere gli elementi Transizione elettroniche nell eccitazione di un atomo per assorbimento di energia e = h = c/ = h c/ c = m s -1
14 a) Una riga spettrale di frequenza n (secondo Bohr). b) doppietto di frequenze n 0 e n 1 (secondo Sommerfeld). Transizioni elettroniche e serie di righe caratteristiche dello spettro dell atomo d idrogeno.
15 Secondo numero quantico o numero quantico angolare l b = semiasse minore; a = semiasse maggiore b 0 a 1 n l 0 1 n 0 n l l n n l n l 0 0 l n 1
16 Terzo numero quantico o numero quantico magnetico m Effetto Zeeman M // L h L z m m l Compreso lo zero m =-,-1,0,+1,+ B Campo magnetico esterno Situazione per l =
17 n = 1,, 3, 4,..n (numero quantico principale) l = 0, 1,, 3,.(n-1) (numero quantico angolare) m = 0, ±1, ±, ±3 ±l (numero quantico magnetico) Ms = ± ½ (numero quantico di spin)
18
19 Per i fotoni Planck Einstein avevano scritto: ε hc λ h ν mc mc ed essendo ν c λ Le onde di De Broglie λ h mc h = costante di Planck j sec h λ = lunghezza d onda m v m = massa v = velocità
20 Esperienza di Davison e Germer Diffrazione di un fascio di raggi luminosi al passaggio attraverso un piccolo foro (a,b) e diffrazione di un fascio di raggi X (c,d) e di un fascio di elettroni (c,e) al passaggio attraverso una sottile foglia di argento policristallino
21 Onde di De Broglie associate a diversi tipi di particelle λ h mv In cui h= j sec Particella m (g) v cm/sec l (Ǻ) Elettrone lento Elettrone lento Elettrone accelerato da 100 Volt Elettrone accelerato da Volt Protone accelerato da 100 Volt Molecola di H a 00 C Particella a emessa da un nucleo di Ra Sfera di 1/1000 di mg (1mg), v = 1cm/sec Sfera di 1g alla velocità di v = 1cm/sec
22 Equazione che descrive e la propagazione di un onda è: δ f δx δ f δy δ f δz 1 v δ f δt (equazione generale delle onde) f è una funzione delle coordinate x, y, z e del t v è la velocità di propagazione dell'onda d Le onde associate agli elettroni nel loro movimento intorno al nucleo sono onde stazionarie.
23 δ ψ δx δ ψ δy δ ψ δz 4 π λ ψ 0 Dove è la funzione d onda e è la lunghezza d onda. Usando la relazione di De Broglie ( =h/mv), edalmomentochel equazione d onda permette di calcolare i valori degli stati energetici dell atomo e quindi E tot = E cin + E pot 1/mv =E tot E pot si ha: Equazione di Schrödinger (197) δ ψ δx δ ψ δy δ ψ δz 8 π h m (E tot - E pot ) ψ 0
24 Dal punto di vista matematico esistono infinite funzioni d'onda (Y) che sono soluzioni dell'equazione equazione di Schrödinger, ma dal punto di vista fisico solo alcune di queste possono essere accettate e cioè: 1) Deve essere continua e finita ad un solo valore in ogni punto dello spazio eall'infinito it tende azero ) Deve soddisfare alla condizione di normalizzazione, cioè la probabilità di trovare l elettrone, in tutto lo spazio attorno al nucleo, deve essere unitaria x y z ψ dv 1
25 n = r Per De Broglie: λ h mv Quantizzazione di Bohr: h n mv π r mvr n h π
26 Punto di contatto tra la teoria ondulatoria e la teoria Bohr Tabella delle funzioni n l m ms
27 Orbitali atomici Orbitale di tipo s (n = 1,,3 ; l = 0 ; m = 0) La funzione orbitale in un piano Orbitale di tipo p (n =,3 ; l = 1 ; m = -1, 0, +1) La funzione p z in un piano passante per l asse z
28 y Orbitali atomici x La probabilità di trovare l elettrone entro una sfera di raggio r è pari a: P r 0 4 π r Ψ dr
29 Orbitali atomici
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Radiazioni ionizzanti
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
1. Scrivere l equazione di Schrödinger unidimensionale per una particella di massa m con energia potenziale V (x) = mω2
 1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
Introduzione alla meccanica quantistica. Vincenzo Barone
 Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
La struttura dell atomo
 La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
La teoria atomistica
 La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
Problemi con l'atomo. Significato delle righe spettrali. Modello dell'atomo
 Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
FISICA delle APPARECCHIATURE per RADIOTERAPIA
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Il metodo scientifico
 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Università Primo Levi
 Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole.
 1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico. Prof. Stefano Piotto Università di Salerno
 Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
LA FISICA QUANTISTICA
 CAPITOLO 45 LA FISICA QUANTISTICA 1 LE PROPRIETÀ ONDULATORIE DELLA MATERIA 1 L onda è un fenomeno collettivo, che coinvolge un insieme di particelle (le molecole di una fune che oscilla, gli atomi dell
CAPITOLO 45 LA FISICA QUANTISTICA 1 LE PROPRIETÀ ONDULATORIE DELLA MATERIA 1 L onda è un fenomeno collettivo, che coinvolge un insieme di particelle (le molecole di una fune che oscilla, gli atomi dell
La radiazione elettromagnetica. aumento della frequenza n della radiazione aumento dell energia E della radiazione
 La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
Spettro elettromagnetico
 Spettro elettromagnetico Sorgenti Finestre Tipo Oggetti rilevabili Raggi γ ev Raggi X Lunghezza d onda E hc = hν = = λ 12. 39 λ( A o ) Visibile Infrarosso icro onde Onde-radio Dimensione degli oggetti
Spettro elettromagnetico Sorgenti Finestre Tipo Oggetti rilevabili Raggi γ ev Raggi X Lunghezza d onda E hc = hν = = λ 12. 39 λ( A o ) Visibile Infrarosso icro onde Onde-radio Dimensione degli oggetti
LUCE E ONDE ELETTROMAGNETICHE
 LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
Meccanica quantistica Mathesis 2016 Prof. S. Savarino
 Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
La Struttura degli Atomi
 La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
Teoria atomica. Dr. Lucia Tonucci Ingegneria delle Costruzioni
 Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
La teoria del corpo nero
 La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Teoria Quantistica e Struttura Elettronica degli Atomi
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Teoria Quantistica e Struttura Elettronica degli Atomi Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Teoria Quantistica e Struttura Elettronica degli Atomi Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
Crisi della Fisica Classica & Fisica Quantistica
 Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
catastrofe ultravioletta
 Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
p e c = ev Å
 Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
LEZIONE N 28. Corso di Fisica II Prof. Giuseppe Ciancio
 LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi stato fondamentale stati eccitati
 4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
Spettroscopia. Spettroscopia
 Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per
 Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
Equazioni di Maxwell. (legge di Gauss per il campo elettrico) (legge di Gauss per il campo magnetico) C (legge di Faraday)
 Equazioni di Maxwell Φ S ( r E ) = Q ε 0 (legge di Gauss per il campo elettrico) Φ S ( r B ) = 0 (legge di Gauss per il campo magnetico) C l ( r Φ B ) = µ 0 ε S ( E r ) 0 + µ (legge di Ampère - Maxwell)
Equazioni di Maxwell Φ S ( r E ) = Q ε 0 (legge di Gauss per il campo elettrico) Φ S ( r B ) = 0 (legge di Gauss per il campo magnetico) C l ( r Φ B ) = µ 0 ε S ( E r ) 0 + µ (legge di Ampère - Maxwell)
Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti).
 4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
LASER. Light Amplification by Stimulated Emission of Radiation. Introduzione. Assorbimento, emissione spontanea, emissione stimolata
 LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
Struttura elettronica degli atomi. La teoria dei quanti e la meccanica ondulatoria. La moderna descrizione dell atomo
 Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L.
 Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
Radiazione e Materia. Insegnamento di Chimica Generale CCS CHI e MAT. Scuola di Ingegneria Industriale e dell Informazione
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Radiazione e Materia Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Radiazione e Materia Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
L atomo di idrogeno (1) H T = p2 1 2m 1. + p2 2 2m 2. + V ( r 1 r 2 ) (2) Definiamo le nuove variabili: 1. La massa totale M M = m 1 + m 2 (3)
 L atomo di idrogeno Il problema dell atomo di idrogeno é un problema esattamente risolubili ed i suoi risultati possono essere estesi agli atomi idrogenoidi, in cui solo c é solo un elettrone sottoposto
L atomo di idrogeno Il problema dell atomo di idrogeno é un problema esattamente risolubili ed i suoi risultati possono essere estesi agli atomi idrogenoidi, in cui solo c é solo un elettrone sottoposto
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
n(z) = n(0) e m gz/k B T ; (1)
 Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
Introduzione alla Meccanica Quantistica (MQ):
 Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Struttura elettronica degli atomi. La teoria dei quanti e la meccanica ondulatoria. La moderna descrizione dell atomo
 Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
La natura ondulatoria della materia
 La natura ondulatoria della materia 1. Dualismo onda-particella 2. Principio di indeterminazione di Heisemberg 3. Struttura del nucleo XV - 0 Dualismo onda-particella Come la radiazione presenta una doppia
La natura ondulatoria della materia 1. Dualismo onda-particella 2. Principio di indeterminazione di Heisemberg 3. Struttura del nucleo XV - 0 Dualismo onda-particella Come la radiazione presenta una doppia
Prerequisiti Lezione 1. Ripasso
 Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
La complessa semplicità dell'atomo di idrogeno!
 La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Introduzione ai fenomeni quantistici
 Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
dualismo onda corpuscolo
 dualismo onda corpuscolo Gli effetti che abbiamo visto finora sono manifestazioni della natura corpuscolare della radiazione elettromagnetica (e quindi della luce) Naturalmente la natura corpuscolare non
dualismo onda corpuscolo Gli effetti che abbiamo visto finora sono manifestazioni della natura corpuscolare della radiazione elettromagnetica (e quindi della luce) Naturalmente la natura corpuscolare non
LA CRISI DELLA FISICA CLASSICA
 LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
Raccolta di esercizi di fisica moderna
 Raccolta di esercizi di fisica moderna M. Quaglia IIS Avogadro Torino M. Quaglia (IIS Avogadro Torino) Raccolta di esercizi di fisica moderna Torino, 20/11/2014 1 / 30 Prova AIF e Sillabo http://www.aif.it/archivioa/aif_seconda_prova_di_fisica.pdf
Raccolta di esercizi di fisica moderna M. Quaglia IIS Avogadro Torino M. Quaglia (IIS Avogadro Torino) Raccolta di esercizi di fisica moderna Torino, 20/11/2014 1 / 30 Prova AIF e Sillabo http://www.aif.it/archivioa/aif_seconda_prova_di_fisica.pdf
