SINOSSI DEL PROTOCCOLO
|
|
|
- Casimiro Paolini
- 5 anni fa
- Visualizzazioni
Transcript
1 SINOSSI DEL PROTOCCOLO TITOLO: NUMERO DI PROTOCOLLO: STUDIO DI FASE II,RANDOMIZZATO, MULTICENTRICO, IN DOPPIO CIECO, CONTROLLATO VERSO PLACEBO, PER VALUTARE L'EFFICACIA E LA SICUREZZA DI MetMAb IN COMBINAZIONE CON PACLITAXEL + CISPLATINO O CARBOPLATINO COME TRATTAMENTO IN PRIMA LINEA DI PAZIENTI CON CANCRO POLMONARE NON A PICCOLE CELLULE (NSCLC) SQUAMOSO DI STADIO IIIB (PATOLOGIA T4) O IV GO27820 NUMERO EUDRACT: NUMERO IND: PRODOTTO DI PROVA MetMAb (PRO143966, RO ) FASE: II INDICAZIONE: Carcinoma polmonare non a piccole cellule (NSCLC) SPONSOR: F. Hoffmann-La Roche Ltd Obiettivi Obiettivo primario Gli obiettivi co-primari dello studio sono i seguenti: Valutare l'efficacia di MetMAb + paclitaxel + platino (cisplatino o carboplatino) rispetto a placebo + paclitaxel + platino espressa come sopravvivenza libera da progressione (PFS) valutata dallo Sperimentatore Valutare l'efficacia di MetMAb + paclitaxel + platino rispetto a placebo + paclitaxel + platino espressa come sopravvivenza libera da progressione (PFS) valutata dallo Sperimentatore nel sottogruppo di pazienti con NSCLC squamoso Met-positivo Obiettivi secondari Gli obiettivi secondari dello studio sono i seguenti: Valutare l'efficacia di MetMAb + paclitaxel + platino rispetto a placebo + paclitaxel + platino espressa come sopravvivenza globale (OS) in tutti i pazienti e in quelli con NSCLC squamoso Met-positivo Valutare l'efficacia di MetMAb + paclitaxel + platino rispetto a placebo + paclitaxel + platino espressa come tasso di risposta globale (ORR), la durata della risposta (DOR) e tasso di controllo della malattia (DCR) in tutti i pazienti e in quelli con NSCLC squamoso Metpositivo Valutare la sicurezza e tollerabilità di MetMAb + paclitaxel + platino in tutti i pazienti e in quelli con NSCLC squamoso Met-positivo Sinossi in italiano del 1
2 Descrivere la farmacocinetica (PK) di MetMAb quando somministrato con paclitaxel e platino Valutare il possibile effetto di MetMAb sulla farmacocinetica di paclitaxel e platino tramite confronto dei rispettivi trattamenti combinati con MetMAb e placebo Valutare i livelli nel siero e l'incidenza di ATA rispetto a MetMAb Obiettivi esplorativi Gli obiettivi esplorativi dello studio sono i seguenti: Analizzare le potenziali correlazioni tra risposta di immunogenicità e farmacocinetica, sicurezza e attività Valutare la potenziale associazione di tessuto da analizzare, biomarcatori nel plasma e nel siero e cellule tumorali in circolazione nel sangue con la risposta al farmaco sperimentale, compresi efficacia e/o eventi avversi, nonché incrementare la conoscenza e la comprensione della biologia di NSCLC Disegno dello studio Descrizione dello studio Si tratta di uno studio randomizzato, di fase II, multicentrico, in doppio cieco, controllato da placebo, per valutare e confrontare la sicurezza e l'efficacia di MetMAb in combinazione con paclitaxel + platino rispetto al trattamento con placebo + paclitaxel + platino in pazienti affetti da NSCLC squamoso di Stadio IIIB (patologia T4) o IV incurabile. I pazienti saranno arruolati e randomizzati con un rapporto di 1:1 per ricevere MetMAb + paclitaxel + platino oppure placebo + paclitaxel + platino. I pazienti idonei saranno stratificati in base allo stato della diagnosi di Met (punteggio clinico di 3+ o 2+ vs. 1+ o 0, vedere appendice 3). I pazienti riceveranno un massimo di 4 cicli (ciascun ciclo è di 21 giorni) di chemioterapia associata a placebo o a MetMab. I pazienti la cui malattia non sarà progredita dopo 4 cicli di chemioterapia + placebo o MetMAb proseguiranno il trattamento con MetMAb o placebo come trattamento di mantenimento. Il trattamento di mantenimento continuerà fino a progressione della malattia, tossicità inaccettabile o decesso. Le valutazioni della risposta del tumore avverranno ogni 6 settimane (± 7 giorni) durante la somministrazione della chemioterapia di induzione, quindi ogni 9 settimane (± 7 giorni) durante la terapia di mantenimento. La risposta si baserà sui Criteri di valutazione della risposta nei tumori solidi, versione 1.1 (RECIST v1.1). Il rilevamento dei dati di follow-up, compresi quelli relativi a terapie anticancro successive, continuerà per ciascun paziente sino alla sua morte o alla conclusione dello studio. Gli endpoint di sicurezza e di efficacia saranno valutati in tutti i pazienti arruolati e in base allo stato di diagnosi Met. Oltre alla sorveglianza della sicurezza standard in questo studio, verranno istituiti due comitati per valutare la sicurezza della sperimentazione, al fine di garantire la sicurezza dei pazienti con NSCLC Met-negativo randomizzati nel trattamento MetMAb (vedere sezione 3.1.2). La farmacocinetica di MetMAb sarà valutata in tutti i pazienti. A circa 20 pazienti per ogni braccio di trattamento sarà prelevato un campione aggiuntivo per la farmacocinetica in siti clinici predefiniti, per valutare il potenziale effetto di MetMAb su paclitaxel e cisplatino o carboplatino. I siti clinici saranno selezionati per la loro capacità e volontà di effettuare un campionamento aggiuntivo per la farmacocinetica. I pazienti arruolati in questi siti selezionati, indipendentemente dal loro regime, avranno la possibilità di acconsentire e sottoporsi al campionamento aggiuntivo per la farmacocinetica. Numero dei pazienti Almeno 110 pazienti in totale saranno randomizzati fino all'arruolamento di 55 pazienti con tumori Met-positivi (vedere sezione 6.1 per ulteriori dettagli sulle dimensioni del campione). L'arruolamento di pazienti con NSCLC squamoso Met-negativo sarà interrotto a quota 55 pazienti. Sinossi del protocollo in italiano, versione 2 2
3 Popolazione target Per l'ingresso nello studio i pazienti devono soddisfare i criteri seguenti: Capacità e volontà di fornire un consenso informato scritto e aderire al protocollo dello studio Sesso maschile o femminile ed età 18 anni Stato di performance ECOG 0 o 1 Tumori NSCLC di istologia squamosa di Stadio IIIB (T4 N2M0 o T4N3M0) o IV confermato istologicamente o citologicamente I pazienti con NSCLC di Stadio IIIB sono idonei solo se la loro patologia non può essere curata con chirurgia definitiva o radioterapia. I pazienti con metastasi cerebrali trattate e stabili sono idonei a condizione che non presentino evidenze di progressione dopo il trattamento e non abbiano necessità in atto di assumere desametasone o altri corticosteroidi. Nessuna precedente chemioterapia per NSCLC squamoso Tessuto adeguato per test immunoistochimico centrale del recettore Met e test EGFR se lo stato EGFR non è noto Vedere sezione per requisiti sul tessuto. Evidenza radiografica della patologia (una patologia misurabile è da preferire, ma non obbligatoria) Per le donne non in stato di post-menopausa (12 mesi di amenorrea) o non sterili in seguito a intervento chirurgico (assenza di ovaie e/o utero): accordo a utilizzare un metodo contraccettivo adeguato durante il periodo di trattamento e per almeno 90 giorni dopo l ultima dose di farmaco dello studio Per i pazienti di sesso maschile la cui compagna è in pre-menopausa: accordo a utilizzare un metodo contraccettivo a barriera durante il periodo di trattamento e per almeno 90 giorni dopo l ultima dose di farmaco dello studio I pazienti che soddisfano uno qualsiasi dei criteri seguenti saranno esclusi dallo studio: Criteri correlati al cancro Trattamento sistemico precedente per NSCLC squamoso di Stadio IIIB o IV NSCLC classificato istologicamente come adenocarcinoma, a cellule grandi, misto adenosquamoso o NSCLC non altrimenti specificato (NOS) Precedente esposizione a trattamento sperimentale mirato a HGF o Met Pazienti con tumori per i quali è stata confermata la presenza di mutazioni con attivazione di EGFR, idonei alla terapia anti-egfr (per esempio gefitinib o erlotinib), secondo quanto determinato dallo Sperimentatore Metastasi cerebrali incontrollate e trattamento tramite resezione neurochirurgica o biopsia cerebrale nelle 4 settimane precedenti il Giorno 1 del Ciclo 1 Storia di un'altra malignità nei 3 anni precedenti, con intervallo libero da malattia < 3 anni I pazienti con storia precedente di cancro in situ o cancro della pelle a cellule basali o squamose sono idonei. Funzione ematologica, biochimica e organica Conta granulocitica 1500/mm 3 ; conta piastrinica /mm 3 ed emoglobina 9,0 g/dl nei 7 giorni precedenti l'arruolamento Tempo di tromboplastina parziale (PTT), rapporto normalizzato internazionale (INR) o tempo di protrombina (PT) > 1,5 il limite superiore di normalità (ULN) (tranne per pazienti che ricevono una terapia anticoagulante) Sinossi del protocollo in italiano, versione 2 3
4 AST (SGOT), ALT (SGPT), fosfatasi alcalina (ALP) 2,5 ULN; [ 5 ULN con metastasi epatiche] Bilirubina totale 1,5 ULN (tranne per pazienti con diagnosi di malattia di Gilbert). Calcio nel siero ULN corretto per basse concentrazioni dell albumina sierica Creatinina sierica 1,5 ULN o clearance della creatinina calcolata (CrCl) 60 ml/min (Cockcroft e Gault) Diabete incontrollato, come dimostrato da livello di glucosio nel siero a digiuno 200 mg/dl Sinossi del protocollo in italiano, versione 2 4
5 In generale Gravidanza o allattamento (o test di gravidanza positivo nelle 48 precedenti l'assunzione di un qualsiasi componente del farmaco sperimentale) Storia significativa di patologia cardiovascolare (cioè angina instabile, ipertensione incontrollata, insufficienza cardiaca congestizia, definita dalla New York Heart Association [NYHA] di classe II, III o IV) nei 6 mesi precedenti il Giorno 1 del Ciclo 1, infarto miocardico nell'anno precedente o attuale aritmia ventricolare cardiaca da trattare con farmaci Infezione attiva grave ( grado 3) al momento della randomizzazione o altre gravi condizioni mediche di base che comprometterebbero la capacità del paziente di ricevere il trattamento del protocollo Pazienti con positività nota all'hiv Qualsiasi condizione (cioè psicologica, geografica, ecc.) che non consente di aderire alle procedure dello studio e di follow-up Aspettativa di vita 12 settimane Assunzione di un farmaco sperimentale nei 28 giorni precedenti l'inizio del trattamento dello studio Sensibilità nota a un componente qualsiasi di cisplatino, carboplatino o paclitaxel Importante intervento o procedura di tipo chirurgico, biopsia aperta, pleurodesi aperta o lesione traumatica significativa nei 28 giorni precedenti il Giorno 1 del Ciclo 1 oppure una necessità anticipata di intervento chirurgico importante durante lo studio Lunghezza dello studio La durata totale dello studio è di circa 32 mesi, compresi 30 mesi di andamento progressivo e 2 mesi di follow-up (in seguito all'arruolamento dell'ultimo paziente). Fine dello studio L'analisi di efficacia sarà effettuata quando si saranno manifestati 44 eventi PFS valutati dallo Sperimentatore in pazienti con tumori Met-positivi e 88 eventi PFS nella popolazione ITT. Il followup per la sopravvivenza proseguirà fino a quando tutti i pazienti saranno morti, risulteranno persi al follow-up oppure fino a quando lo Sponsor non deciderà di terminare lo studio, a seconda dell'evento che si verificherà per primo. In base al risultato dello studio, i pazienti potranno continuare il trattamento, qualora ne stiano traendo beneficio, con follow-up di sicurezza continuo. Misure di esito di efficacia La misura di esito di efficacia primaria viene definita come segue: Sopravvivenza libera da progressione (PFS), definita come il tempo tra la data della randomizzazione e la data della prima progressione documentata della malattia o del decesso, a seconda dell'evento che si verificherà per primo. La progressione della malattia sarà determinata sulla base della valutazione dello Sperimentatore tramite RECIST v1.1. La misura di esito di efficacia secondaria viene definita come segue: Sopravvivenza globale (OS) definita come il tempo intercorso dalla randomizzazione al decesso per qualsiasi causa Tasso di risposta globale (ORR), definito come la percentuale di pazienti che secondo lo Sperimentatore ottengono una risposta oggettiva in base a RECIST v.1.1 Durata della risposta (DOR), definita come il tempo intercorso tra la prima manifestazione di una risposta oggettiva documentata e la progressione della malattia (determinata dallo Sperimentatore tramite RECIST v1.1) o il decesso per qualsiasi causa durante lo studio Tasso di controllo della malattia (DCR) (tasso di risposta parziale più risposta completa più malattia stabile per almeno 6 settimane), determinato dallo Sperimentatore tramite RECIST v1.1 Sinossi del protocollo in italiano, versione 2 5
6 Misure di esito di sicurezza Le misure di esito di sicurezza per questo studio vengono definite come segue: Incidenza, natura e gravità degli eventi avversi, compresi eventi avversi gravi Variazioni nei risultati delle analisi cliniche di laboratorio e nelle misurazioni dei segni vitali prima e dopo la somministrazione del farmaco sperimentale Incidenza e livelli nel siero di ATA rispetto a MetMAb Misure di esito di farmacocinetica Le misure di esito di farmacocinetica per questo studio vengono definite come segue: Concentrazione di MetMAb nel siero prima del dosaggio (C min ) il Giorno 1 dei Cicli 1, 2 e 4 e al termine dello studio Concentrazione di MetMAb nel siero dopo il dosaggio (C max ) il Giorno 1 dei Cicli 1, 2 e 4 e al termine dello studio Parametri farmacocinetici per paclitaxel nel plasma il Giorno 1 dei Cicli 1 e 4 (circa 20 pazienti per braccio) Parametri farmacocinetici per platino ultrafiltrabile e totale nel plasma il Giorno 1 dei Cicli 1 e 4 (circa 20 pazienti per braccio) Farmaci sperimentali Prodotto sperimentale MetMAb (15 mg/kg per via endovenosa) ogni 21 giorni; fino a 4 cicli durante il trattamento di induzione; in assenza di progressione della malattia, terapia di mantenimento fino alla progressione della malattia, al decesso o al manifestarsi di tossicità inaccettabile, a seconda dell'evento che si verifica per primo. Comparatore Placebo (dose, percorso e regime identici a quelli descritti per MetMAb). Farmaci non sperimentali Paclitaxel (200 mg/m 2 IV) ogni 21 giorni (fino a 4 cicli) Cisplatino (75 mg/m 2 per via endovenosa) o carboplatino (AUC 6 per via endovenosa) ogni 21 giorni (fino a 4 cicli) Metodi statistici Le analisi di efficacia comprenderanno tutti i pazienti inclusi nella randomizzazione (la popolazione ITT), con pazienti assegnati al braccio di trattamento nel quale sono stati randomizzati. Gli stessi metodi di analisi per analisi primaria e secondaria saranno applicati sia alla popolazione ITT, sia alla popolazione con tumori Met-positivi. Analisi primaria PFS definita come il tempo tra la data della randomizzazione e la data della prima progressione documentata della malattia o del decesso, a seconda dell'evento che si verifica per primo. La progressione della malattia sarà determinata sulla base della valutazione dello Sperimentatore tramite RECIST v1.1. I pazienti che che non avranno subito una progressione della malattia o non risulteranno deceduti al momento dell'analisi saranno censiti al momento dell'ultima valutazione del tumore. I pazienti con nessuna valutazione del tumore post-baseline saranno censiti alla data di randomizzazione. Per la stima della PFS media per ciascun braccio di trattamento sarà impiegata la metodologia Kaplan-Meier; sarà inoltre costruita la curva Kaplan Meier per rappresentare visivamente la differenza tra i bracci di trattamento. Le stime dell'effetto del trattamento saranno espresse come HR tramite un modello di Cox stratificato mediante stato di diagnosi Met, comprendente intervalli di confidenza al 95%. Sinossi del protocollo in italiano, versione 2 6
7 Determinazione delle dimensioni del campione Lo studio di fase II è concepito per consentire una valutazione preliminare dell'efficacia e della sicurezza di MetMAb in combinazione con paclitaxel + platino in pazienti con NSCLC squamoso di Stadio IIIB (patologia T4) o IV in un contesto in prima linea. Una speciale attenzione viene dedicata ai risultati nei pazienti con tumori Met-positivi. Per lo studio saranno arruolati circa 110 pazienti. L'arruolamento di pazienti con NSCLC squamoso Met-negativo sarà interrotto a quota 55 pazienti. Per la valutazione dell'endpoint primario i pazienti saranno seguiti fino al punto in cui lo Sperimentatore osserverà almeno 44 eventi PFS tra i pazienti con tumori Met-positivi e 88 PFS nella popolazione ITT. Ipotizzando che la PFS media nel braccio di controllo sia di circa 4 mesi e l'hr target sia 0,67, esso può essere raggiunto circa 2 mesi dopo l'arruolamento dell'ultimo paziente. Questo studio genera delle ipotesi e sarà in grado di rilevare solo un beneficio di ampia portata fornito dalla terapia combinata a base di MetMAb + paclitaxel + platino nella popolazione ITT e nel sottogruppo di pazienti con tumori Met-positivi. Ad esempio, con 44 eventi in pazienti con tumori Met-positivi c'è l'80% di potenza di rilevare, con un livello di significatività di 0,05 bilaterale, un HR di 0,43 nel braccio MetMAb + paclitaxel + platino rispetto al braccio con placebo; con 88 eventi c'è l'80% di potenza di rilevare, con un livello di significatività di 0,05 bilaterale, un HR di 0,55 nella popolazione ITT. Questo studio non avrà una potenza adeguata per rilevare differenze con significatività clinica minima tra i bracci di trattamento. Ad esempio, con 44 eventi PFS c'è solo il 26% di potenza di rilevare un HR di 0,67 e con 88 eventi PFS c'è solo il 47% di potenza di rilevare un HR di 0,67. Pertanto, il test dell'ipotesi formale è limitato dal fatto che a livello statistico, risultati negativi non portano necessariamente a effetti di trattamento significativi sul piano clinico. Analisi ad interim In tre momenti predefiniti saranno convocati IMC e SOC (vedere sezione 3.1.2) per valutare la sicurezza nello studio. Verrà prestata particolare attenzione ai risultati dei pazienti con tumori Met-negativi. Sinossi del protocollo in italiano, versione 2 7
SINOSSI DEL PROTOCCOLO
 Protocollo GO27821, versione 2 SINOSSI DEL PROTOCCOLO TITOLO: NUMERO DI PROTOCOLLO: STUDIO DI FASE II, RANDOMIZZATO, MULTICENTRICO, IN DOPPIO CIECO, CONTROLLATO VERSO PLACEBO, PER VALUTARE L'EFFICACIA
Protocollo GO27821, versione 2 SINOSSI DEL PROTOCCOLO TITOLO: NUMERO DI PROTOCOLLO: STUDIO DI FASE II, RANDOMIZZATO, MULTICENTRICO, IN DOPPIO CIECO, CONTROLLATO VERSO PLACEBO, PER VALUTARE L'EFFICACIA
Sinossi di studio clinico Codice: GECP06/01 Pag. 1 di 5
 Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Studio AMAROS SOMMARIO
 Studio AMAROS SOMMARIO Studio di fase III il cui principale obiettivo è dimostrare nelle pazienti con metastasi ai linfonodi ascellari, diagnosticate tramite biopsia con linfonodo sentinella, equivalente
Studio AMAROS SOMMARIO Studio di fase III il cui principale obiettivo è dimostrare nelle pazienti con metastasi ai linfonodi ascellari, diagnosticate tramite biopsia con linfonodo sentinella, equivalente
SINOSSI. Studio di Fase II: Obiettivo primario Determinare l attività antitumorale della combinazione in termini di tempo alla progressione
 SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
Autori: Pierandrea De Iaco, Anna Myriam Perrone. Documento: Protocollo. Versione: Finale del 24 Dicembre 2012. Numero di pagine: 7
 Codice dello studio: SIRENA (Studio Ipertermia REtrospettivo NAzionale) Studio osservazionale multicentrico retrospettivo sulla Chemioterapia Ipertermica Intraperitoneale nel carcinoma avanzato dell ovaio
Codice dello studio: SIRENA (Studio Ipertermia REtrospettivo NAzionale) Studio osservazionale multicentrico retrospettivo sulla Chemioterapia Ipertermica Intraperitoneale nel carcinoma avanzato dell ovaio
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO Titolo Numero di protocollo Studio multicentrico, in aperto, randomizzato e adattivo di palifosfamide-tris, un nuovo DNA crosslinker, in combinazione con chemioterapia con carboplatino
SINOSSI DEL PROTOCOLLO Titolo Numero di protocollo Studio multicentrico, in aperto, randomizzato e adattivo di palifosfamide-tris, un nuovo DNA crosslinker, in combinazione con chemioterapia con carboplatino
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
ABRAXANE (nab-paclitaxel) - Carcinoma pancreas esocrino
 Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
Algoritmi e percorsi terapeutici dei Carcinomi del Polmone
 Algoritmi e percorsi terapeutici dei Carcinomi del Polmone Standard Individualizzata Sperimentale Stadio Ia/Ib T1-2a N0 M0 radicale) CHIR con resezione sub-lobare, solo stadio Ib CHIR con VATS campionamento
Algoritmi e percorsi terapeutici dei Carcinomi del Polmone Standard Individualizzata Sperimentale Stadio Ia/Ib T1-2a N0 M0 radicale) CHIR con resezione sub-lobare, solo stadio Ib CHIR con VATS campionamento
SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE
 SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE Studio prospettico, non interventistico, di coorte, sul rischio di tromboembolismo venoso (TEV) in pazienti sottoposti a un nuovo trattamento chemioterapico per
SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE Studio prospettico, non interventistico, di coorte, sul rischio di tromboembolismo venoso (TEV) in pazienti sottoposti a un nuovo trattamento chemioterapico per
BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO
 BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO Nome dello sponsor Nome del prodotto finito Nome del principio attivo Titolo dello studio Sperimentatore Principale Centri dello studio pianificati Periodo di
BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO Nome dello sponsor Nome del prodotto finito Nome del principio attivo Titolo dello studio Sperimentatore Principale Centri dello studio pianificati Periodo di
Specialità: Avastin(Roche spa)
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI SORAFENIB L01XE05 (Nexavar ) Presentata da Commissione Terapeutica Provinciale di Sassari In data gennaio 2009 Per le seguenti motivazioni: Sorafenib modifica lo standard
RICHIESTA DI INSERIMENTO IN PTR DI SORAFENIB L01XE05 (Nexavar ) Presentata da Commissione Terapeutica Provinciale di Sassari In data gennaio 2009 Per le seguenti motivazioni: Sorafenib modifica lo standard
16th World Conference on Lung Cancer (WCLC): highlights
 16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci
 Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci Negli ultimi anni c è stato un notevole cambiamento nella gestione diagnosticoterapeutica dei soggetti affetti da neoplasia
Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci Negli ultimi anni c è stato un notevole cambiamento nella gestione diagnosticoterapeutica dei soggetti affetti da neoplasia
RAD001. Sinossi del protocollo dello studio CRAD001N2301. Codice EUDRACT 2008-000498-40. Fase di sviluppo
 RAD001 Sinossi protocollo lo studio CRAD001N2301 Studio multicentrico, randomizzato, in doppio cieco, controllato versus placebo, di fase III, con terapia adiuvante con RAD001 in pazienti con linfoma diffuso
RAD001 Sinossi protocollo lo studio CRAD001N2301 Studio multicentrico, randomizzato, in doppio cieco, controllato versus placebo, di fase III, con terapia adiuvante con RAD001 in pazienti con linfoma diffuso
STUDIO CLINICO di Fase II MYETT MYocet Endoxan Taxotere Trastuzumab. Sinossi del protocollo
 1 STUDIO CLINICO di Fase II MYETT MYocet Endoxan Taxotere Trastuzumab Sinossi del protocollo Titolo Protocollo: Studio di fase II con doxorubicina liposomiale più ciclofosfamide in associazione a trastuzumab,
1 STUDIO CLINICO di Fase II MYETT MYocet Endoxan Taxotere Trastuzumab Sinossi del protocollo Titolo Protocollo: Studio di fase II con doxorubicina liposomiale più ciclofosfamide in associazione a trastuzumab,
SINOSSI DELLO STUDIO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO
 SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO
 1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B.
 O-CLL1 CHRONIC LYMPHOCYTIC LEUKEMIA PROGNOSTIC FACTOR PROJECT Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B. O-CLL1-PROTOCOL Sinossi O-CLL1-sinossi,
O-CLL1 CHRONIC LYMPHOCYTIC LEUKEMIA PROGNOSTIC FACTOR PROJECT Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B. O-CLL1-PROTOCOL Sinossi O-CLL1-sinossi,
E.Molfese, P.Matteucci, A.Iurato, M. Fiore, L.E. Trodella, L. Poggesi, R.M. D Angelillo, E. Iannacone, L.Trodella!
 Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel.
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
NSCLC - stadio iiib/iv
 I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
I pazienti con diabete di tipo 1 sono in gran parte giovani, ma sono una piccola minoranza rispetto al totale. La maggior parte dei diabetici,
 DIABETE Per quali pazienti diabetici è indicato il trapianto di rene? I pazienti diabetici più comunemente inseriti in lista di trapianto renale sono quelli in cui il diabete è dovuto a un'insufficiente
DIABETE Per quali pazienti diabetici è indicato il trapianto di rene? I pazienti diabetici più comunemente inseriti in lista di trapianto renale sono quelli in cui il diabete è dovuto a un'insufficiente
Domande relative alla specializzazione in: Oncologia medica
 Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
Titolo MITO 8. Fase. Obiettivo primario. Obiettivi secondari
 Titolo MITO 8 Fase Obiettivo primario Obiettivi secondari Studio internazionale multicentrico randomizzato di fase III per valutare l impatto sulla sopravvivenza del prolungamento dell intervallo libero
Titolo MITO 8 Fase Obiettivo primario Obiettivi secondari Studio internazionale multicentrico randomizzato di fase III per valutare l impatto sulla sopravvivenza del prolungamento dell intervallo libero
CHEMIOTERAPIA NEL NSCLC
 LA CHEMIOTERAPIA NEL TUMORE POLMONARE Dr. Antonio Ardizzoia, Dr.ssa Ilaria Colombo, Dr. Paolo Bidoli UO DI ONCOLOGIA MEDICA - AO SAN GERARDO DI MONZA CHEMIOTERAPIA NEL NSCLC Il ruolo della terapia medica
LA CHEMIOTERAPIA NEL TUMORE POLMONARE Dr. Antonio Ardizzoia, Dr.ssa Ilaria Colombo, Dr. Paolo Bidoli UO DI ONCOLOGIA MEDICA - AO SAN GERARDO DI MONZA CHEMIOTERAPIA NEL NSCLC Il ruolo della terapia medica
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO Codice e titolo del protocollo EGF114299: Studio di fase III per confrontare la sicurezza e l'efficacia di lapatinib più trastuzumab più un inibitore dell'aromatasi (IA) rispetto
SINOSSI DEL PROTOCOLLO Codice e titolo del protocollo EGF114299: Studio di fase III per confrontare la sicurezza e l'efficacia di lapatinib più trastuzumab più un inibitore dell'aromatasi (IA) rispetto
Carcinoma ovarico avanzato: caso clinico Alessandro Inno
 Carcinoma ovarico avanzato: caso clinico Alessandro Inno UOC di Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar - Verona Negrar, 16 febbraio 2015 Presentazione clinica Silvana, 65 anni Anamnesi
Carcinoma ovarico avanzato: caso clinico Alessandro Inno UOC di Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar - Verona Negrar, 16 febbraio 2015 Presentazione clinica Silvana, 65 anni Anamnesi
IMAGE GUIDED RADIATION THERAPY (IGRT) DEL TUMORE DEL POLMONE NON A PICCOLE CELLULE CON IPOFRAZIONAMENTO DELLA DOSE (IGIM Trial)
 Versione 04.06.2012 PROTOCOLLO DI STUDIO IMAGE GUIDED RADIATION THERAPY (IGRT) DEL TUMORE DEL POLMONE NON A PICCOLE CELLULE CON IPOFRAZIONAMENTO DELLA DOSE (IGIM Trial) COORDINATORE PROGETTO DI RICERCA
Versione 04.06.2012 PROTOCOLLO DI STUDIO IMAGE GUIDED RADIATION THERAPY (IGRT) DEL TUMORE DEL POLMONE NON A PICCOLE CELLULE CON IPOFRAZIONAMENTO DELLA DOSE (IGIM Trial) COORDINATORE PROGETTO DI RICERCA
Incidenza, mortalità e sopravvivenza per tumore in Italia nel 2015
 I numeri del cancro in Italia 2015 Ministero della Salute - Roma 24 Settembre 2015 Incidenza, mortalità e sopravvivenza per tumore in Italia nel 2015 Carmine Pinto Presidente Nazionale AIOM I quesiti per
I numeri del cancro in Italia 2015 Ministero della Salute - Roma 24 Settembre 2015 Incidenza, mortalità e sopravvivenza per tumore in Italia nel 2015 Carmine Pinto Presidente Nazionale AIOM I quesiti per
Protocollo di studio clinico o epidemiologico
 Protocollo di studio clinico o epidemiologico Esempi e struttura Esempio 1 (1) Titolo: gli eventi trombo-embolici nei pazienti con tumori a cellule germinali e trattati con chemioterapia Background: all
Protocollo di studio clinico o epidemiologico Esempi e struttura Esempio 1 (1) Titolo: gli eventi trombo-embolici nei pazienti con tumori a cellule germinali e trattati con chemioterapia Background: all
Sviluppo di un tumore
 TUMORI I tumori Si tratta di diversi tipi di malattie, che hanno cause diverse e che colpiscono organi e tessuti differenti Caratteristica di tutti i tumori è la proliferazione incontrollata di cellule
TUMORI I tumori Si tratta di diversi tipi di malattie, che hanno cause diverse e che colpiscono organi e tessuti differenti Caratteristica di tutti i tumori è la proliferazione incontrollata di cellule
I markers biologici come fattori predittivi di efficacia terapeutica nei tumori solidi: l esperienza di Varese
 I markers biologici come fattori predittivi di efficacia terapeutica nei tumori solidi: l esperienza di Varese Daniela Furlan U.O. Anatomia Patologica, Ospedale di Circolo e Fondazione Macchi, Varese Il
I markers biologici come fattori predittivi di efficacia terapeutica nei tumori solidi: l esperienza di Varese Daniela Furlan U.O. Anatomia Patologica, Ospedale di Circolo e Fondazione Macchi, Varese Il
MINI SCHEDA HTA CRIZOTINIB (XALKORI )
 1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
TAILOR AIFA TArceva Italian Lung Optimization trial
 H TAILR AIFA TArceva Italian Lung ptimization trial ttimizzazione dell erlotinib per il trattamento di pazienti con tumore del polmone avanzato non a piccole cellule: uno studio italiano randomizzato SISSI
H TAILR AIFA TArceva Italian Lung ptimization trial ttimizzazione dell erlotinib per il trattamento di pazienti con tumore del polmone avanzato non a piccole cellule: uno studio italiano randomizzato SISSI
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI GEFITINIB ATC L01XE02 (IRESSA ) Presentata da Dott. A. Contu Direttore Oncologia medica ASL 1 Sassari In data luglio 2010 Per le seguenti motivazioni: Iressa è l unico
RICHIESTA DI INSERIMENTO IN PTR DI GEFITINIB ATC L01XE02 (IRESSA ) Presentata da Dott. A. Contu Direttore Oncologia medica ASL 1 Sassari In data luglio 2010 Per le seguenti motivazioni: Iressa è l unico
Elecsys HE4 e CA 125 II. Per una miglior cura della paziente con carcinoma ovarico
 Elecsys HE4 e CA 125 II Per una miglior cura della paziente con carcinoma ovarico HE4, proteina 4 dell epididimo umano Diagnosi precoce e monitoraggio del carcinoma ovarico Il carcinoma ovarico è la quarta
Elecsys HE4 e CA 125 II Per una miglior cura della paziente con carcinoma ovarico HE4, proteina 4 dell epididimo umano Diagnosi precoce e monitoraggio del carcinoma ovarico Il carcinoma ovarico è la quarta
Gefitinib (23-09-2010)
 Gefitinib (23-09-2010) Specialità: Iressa(Astrazeneca Spa) Forma farmaceutica: 30 CPR 250 mg - Prezzo: euro 3.615 ATC: L01XE02 Categoria terapeutica: Inibitori della proteina chinasi Fascia di rimborsabilità:
Gefitinib (23-09-2010) Specialità: Iressa(Astrazeneca Spa) Forma farmaceutica: 30 CPR 250 mg - Prezzo: euro 3.615 ATC: L01XE02 Categoria terapeutica: Inibitori della proteina chinasi Fascia di rimborsabilità:
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
IL POLIPO MALIGNO IL POLIPO MALIGNO
 2007 Polipo maligno: Polipo in cui strutture ghiandolari adenocarcinomatose hanno superato la muscolaris mucosae con infiltrazione della sottomucosa. Secondo la classificazione TNM, il polipo maligno corrisponde
2007 Polipo maligno: Polipo in cui strutture ghiandolari adenocarcinomatose hanno superato la muscolaris mucosae con infiltrazione della sottomucosa. Secondo la classificazione TNM, il polipo maligno corrisponde
Sponsor. III Obiettivi Primari
 Titolo Sponsor ITACA-S 2 (Intergruppo Nazionale Adiuvante Gastrico 2): Confronto tra l efficacia di un trattamento chemioterapico peri-operatorio e un trattamento chemioterapico post-operatorio in pazienti
Titolo Sponsor ITACA-S 2 (Intergruppo Nazionale Adiuvante Gastrico 2): Confronto tra l efficacia di un trattamento chemioterapico peri-operatorio e un trattamento chemioterapico post-operatorio in pazienti
30/05/2011. Carcinoma esofageo. Anatomia. scaricato da www.sunhope.it 1
 Carcinoma esofageo 1 Anatomia 2 scaricato da www.sunhope.it 1 3 Epidemiologia ed Eziologia 4 scaricato da www.sunhope.it 2 Epidemiologia ed Eziologia Costituisce il 50% di tutta la patologia d organo 7%
Carcinoma esofageo 1 Anatomia 2 scaricato da www.sunhope.it 1 3 Epidemiologia ed Eziologia 4 scaricato da www.sunhope.it 2 Epidemiologia ed Eziologia Costituisce il 50% di tutta la patologia d organo 7%
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE
 DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
Casi di IFI in pazienti sottoposti a HSCT allogenico con GVHD
 Casi di IFI in pazienti sottoposti a HSCT allogenico con GVHD Sindrome polmonare Sindrome sino-facciale Terapia pre-emptive Sepsi Sindrome al CNS Sindrome cutanea 58 CASO #1 Sepsi nel HSCT allogenico:
Casi di IFI in pazienti sottoposti a HSCT allogenico con GVHD Sindrome polmonare Sindrome sino-facciale Terapia pre-emptive Sepsi Sindrome al CNS Sindrome cutanea 58 CASO #1 Sepsi nel HSCT allogenico:
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI
 STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
coin lesion polmonare
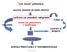 coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE CONSIDERATO ETICO
 COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
Specialità: Herceptin (Roche spa) Forma farmaceutica:
 TRASTUZUMAB per l'indicazione: in associazione ad un inibitore dell aromatasi nel trattamento di pazienti in postmenopausa affetti da carcinoma mammario metastatico positivo per i recettori ormonali, non
TRASTUZUMAB per l'indicazione: in associazione ad un inibitore dell aromatasi nel trattamento di pazienti in postmenopausa affetti da carcinoma mammario metastatico positivo per i recettori ormonali, non
TERAPIA DEL CARCINOMA POLMONARE NON A PICCOLE CELLULE (NSCLC)
 TERAPIA DEL CARCINOMA POLMONARE NON A PICCOLE CELLULE (NSCLC) Negli ultimi anni vi è stata una evoluzione delle strategie terapeutiche nel NSCLC e l introduzione nella pratica clinica di nuovi farmaci
TERAPIA DEL CARCINOMA POLMONARE NON A PICCOLE CELLULE (NSCLC) Negli ultimi anni vi è stata una evoluzione delle strategie terapeutiche nel NSCLC e l introduzione nella pratica clinica di nuovi farmaci
RIASSUNTO DEL PROTOCOLLO H3E-EW-S128
 RIASSUNTO DEL PROTOCOLLO H3E-EW-S128 Titolo della Sperimentazione Clinica: Phase 2 Study of Pemetrexed and Cisplatin as Induction, Followed by Pemetrexed and Cisplatin with Concurrent Thoracic Radiotherapy,
RIASSUNTO DEL PROTOCOLLO H3E-EW-S128 Titolo della Sperimentazione Clinica: Phase 2 Study of Pemetrexed and Cisplatin as Induction, Followed by Pemetrexed and Cisplatin with Concurrent Thoracic Radiotherapy,
SINOSSI DELLO STUDIO
 SINOSSI DELLO STUDIO Titolo Anamorelin HCl nel trattamento del carcinoma polmonare non a piccole cellule Cachessia (NSCLC-C): Studio randomizzato, in doppio cieco, placebo-controllato, multicentrico di
SINOSSI DELLO STUDIO Titolo Anamorelin HCl nel trattamento del carcinoma polmonare non a piccole cellule Cachessia (NSCLC-C): Studio randomizzato, in doppio cieco, placebo-controllato, multicentrico di
TR1US STUDY TRABECTEDIN F1RST LINE THERAPY IN UNFIT SARCOMA STUDY
 TR1US vers. 1.1 23 Aug 2013 Sinossi Final ITA TR1US STUDY TRABECTEDIN F1RST LINE THERAPY IN UNFIT SARCOMA STUDY SAFETY AND ACTIVITY OF TRABECTEDIN AS FIRST LINE IN ADVANCED SOFT TISSUE SARCOMA (STS) PATIENTS
TR1US vers. 1.1 23 Aug 2013 Sinossi Final ITA TR1US STUDY TRABECTEDIN F1RST LINE THERAPY IN UNFIT SARCOMA STUDY SAFETY AND ACTIVITY OF TRABECTEDIN AS FIRST LINE IN ADVANCED SOFT TISSUE SARCOMA (STS) PATIENTS
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica
 Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Studi clinici controllati in area di elevata incertezza Oncologia Quesito G1
 Studi clinici controllati in area di elevata incertezza Oncologia Quesito G1 Studio randomizzato multicentrico di CONFronto tra ERlotinib e Monochemioterapia nel trattamento di terza linea del tumore polmonare
Studi clinici controllati in area di elevata incertezza Oncologia Quesito G1 Studio randomizzato multicentrico di CONFronto tra ERlotinib e Monochemioterapia nel trattamento di terza linea del tumore polmonare
004-IRCC-10IIS-12 Versione del Protocollo Finale 1.0 27 aprile 2012. Trastuzumab. Pertuzumab Formulazione orale. Roche
 1 SINOSSI Titolo del protocollo: Numero del protocollo: Studio in aperto, di fase II, della combinazione trastuzumab e lapatinib o pertuzumab e trastuzumab in pazienti con carcinoma del colon retto metastatico
1 SINOSSI Titolo del protocollo: Numero del protocollo: Studio in aperto, di fase II, della combinazione trastuzumab e lapatinib o pertuzumab e trastuzumab in pazienti con carcinoma del colon retto metastatico
ˆp(1 ˆp) n 1 +n 2 totale di successi considerando i due gruppi come fossero uno solo e si costruisce z come segue ˆp 1 ˆp 2. n 1
 . Verifica di ipotesi: parte seconda.. Verifica di ipotesi per due campioni. Quando abbiamo due insiemi di dati possiamo chiederci, a seconda della loro natura, se i campioni sono simili oppure no. Ci
. Verifica di ipotesi: parte seconda.. Verifica di ipotesi per due campioni. Quando abbiamo due insiemi di dati possiamo chiederci, a seconda della loro natura, se i campioni sono simili oppure no. Ci
SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
Sinossi dell studio GIMEMA AML 1310
 Terapia adattata al rischio genetico/citogenetico e basata sulla determinazione della malattia minima residua per pazienti giovani ( 60 anni) affetti da leucemia acuta mieloide di nuova diagnosi EudraCT
Terapia adattata al rischio genetico/citogenetico e basata sulla determinazione della malattia minima residua per pazienti giovani ( 60 anni) affetti da leucemia acuta mieloide di nuova diagnosi EudraCT
LA CHEMIOTERAPIA ORALE IN ASSOCIAZIONE ALLA RADIOTERAPIA
 LA CHEMIOTERAPIA ORALE IN ASSOCIAZIONE ALLA RADIOTERAPIA G.Lazzari, G. Silvano S. C. Radioterapia Oncologica ASL TA/ 1 - Taranto Taranto, 21 gennaio 2005 BACKGROUND Le formulazioni orali di chemioterapia
LA CHEMIOTERAPIA ORALE IN ASSOCIAZIONE ALLA RADIOTERAPIA G.Lazzari, G. Silvano S. C. Radioterapia Oncologica ASL TA/ 1 - Taranto Taranto, 21 gennaio 2005 BACKGROUND Le formulazioni orali di chemioterapia
IMAGE GUIDED RADIATION THERAPY-IGRT DEL TUMORE DELLA PROSTATA CON IPOFRAZIONAMENTO DELLA DOSE
 Versione 2 15.01.13 PROTOCOLLO DI STUDIO IMAGE GUIDED RADIATION THERAPY-IGRT DEL TUMORE DELLA PROSTATA CON IPOFRAZIONAMENTO DELLA DOSE COORDINATORE PROGETTO DI RICERCA REGIONE-UNIVERSITA REGIONE EMILIA
Versione 2 15.01.13 PROTOCOLLO DI STUDIO IMAGE GUIDED RADIATION THERAPY-IGRT DEL TUMORE DELLA PROSTATA CON IPOFRAZIONAMENTO DELLA DOSE COORDINATORE PROGETTO DI RICERCA REGIONE-UNIVERSITA REGIONE EMILIA
CANCRO DEL POLMONE. 1. Epidemiologia 2. Anatomia Patologica 3. Clinica. 4. Diagnostica 5. Stadiazione 6. Tecnica Chirurgica.
 CANCRO DEL POLMONE Prof. Francesco PUMA CANCRO DEL POLMONE 1. Epidemiologia 2. Anatomia Patologica 3. Clinica 4. Diagnostica 5. Stadiazione 6. Tecnica Chirurgica Iter Diagnostico A Stadiazione Istotipo
CANCRO DEL POLMONE Prof. Francesco PUMA CANCRO DEL POLMONE 1. Epidemiologia 2. Anatomia Patologica 3. Clinica 4. Diagnostica 5. Stadiazione 6. Tecnica Chirurgica Iter Diagnostico A Stadiazione Istotipo
PRESENTAZIONE DI UNA CASISTICA RELATIVA ALLE SOPRAVVIVENZE DI 74 CASI DI TUMORI POLMONARI ALLO STADIO T3a-T3b-T4, TRATTATI CON BIOTERAPIA ONCOLOGICA
 PRESENTAZIONE DI UNA CASISTICA RELATIVA ALLE SOPRAVVIVENZE DI 74 CASI DI TUMORI POLMONARI ALLO STADIO T3a-T3b-T4, TRATTATI CON BIOTERAPIA ONCOLOGICA RAZIONALE INCIDENZA PER SESSO ( TAB ) N totale casi
PRESENTAZIONE DI UNA CASISTICA RELATIVA ALLE SOPRAVVIVENZE DI 74 CASI DI TUMORI POLMONARI ALLO STADIO T3a-T3b-T4, TRATTATI CON BIOTERAPIA ONCOLOGICA RAZIONALE INCIDENZA PER SESSO ( TAB ) N totale casi
Fattori prognostici del carcinoma gastrico nell anziano
 DIPARTIMENTO DI SCIENZE MEDICHE E CHIRURGICHE. CLINICA GERIATRICA UNIVERSITà DEGLI STUDI DI PADOVA Fattori prognostici del carcinoma gastrico nell anziano G.Gasparini, C. Santoro, ED. Toffannello, E. Faccioli,
DIPARTIMENTO DI SCIENZE MEDICHE E CHIRURGICHE. CLINICA GERIATRICA UNIVERSITà DEGLI STUDI DI PADOVA Fattori prognostici del carcinoma gastrico nell anziano G.Gasparini, C. Santoro, ED. Toffannello, E. Faccioli,
Trombocitemia essenziale. Paola Guglielmelli (Firenze)
 Trombocitemia essenziale Paola Guglielmelli (Firenze) Incidenza: 1 per 100.000 ab/anno Prevalenza: 10 40 per 100.000 Aumentata conta piastrinica (> 450 x 109/L) Storia naturale della TE Neoplasia mieloproliferativa
Trombocitemia essenziale Paola Guglielmelli (Firenze) Incidenza: 1 per 100.000 ab/anno Prevalenza: 10 40 per 100.000 Aumentata conta piastrinica (> 450 x 109/L) Storia naturale della TE Neoplasia mieloproliferativa
ONYX Therapeutics Protocollo 2011-003 Carfilzomib per iniezione Pagina 1 di 11
 Carfilzomib per iniezione Pagina 1 11 SINOSSI Nome dello Sponsor: Nome del prodotto: Titolo dello stuo e Numero protocollo: Onyx Therapeutics, Inc. Carfilzomib Stuo Fase 3, randomizzato, in aperto carfilzomib
Carfilzomib per iniezione Pagina 1 11 SINOSSI Nome dello Sponsor: Nome del prodotto: Titolo dello stuo e Numero protocollo: Onyx Therapeutics, Inc. Carfilzomib Stuo Fase 3, randomizzato, in aperto carfilzomib
PEMETREXED per il trattamento carcinoma polmonare non a piccole cellule. (Nuovo allargamento indicazione) (27-05-2009)
 PEMETREXED per il trattamento carcinoma polmonare non a piccole cellule. (Nuovo allargamento indicazione) (27-05-2009) Specialità: Alimta (Eli lilly italia spa) Forma farmaceutica: 1 fl di polvere per
PEMETREXED per il trattamento carcinoma polmonare non a piccole cellule. (Nuovo allargamento indicazione) (27-05-2009) Specialità: Alimta (Eli lilly italia spa) Forma farmaceutica: 1 fl di polvere per
RIASSUNTO DEL PROTOCOLLO DI SPERIMENTAZIONE CLINICA P.R.O.S.E.
 RIASSUNTO DEL PROTOCOLLO DI SPERIMENTAZIONE CLINICA P.R.O.S.E. pag 1 di 4 Randomized Proteomic Stratified Phase III Study of Second Line Erlotinib versus Chemotherapy in Patients with Inoperable Non Small
RIASSUNTO DEL PROTOCOLLO DI SPERIMENTAZIONE CLINICA P.R.O.S.E. pag 1 di 4 Randomized Proteomic Stratified Phase III Study of Second Line Erlotinib versus Chemotherapy in Patients with Inoperable Non Small
www.medscape.org/viewarticle/805542
 Lucio Crinò, MD: Salve e benvenuti a questo programma. Sono Lucio Crinò, un oncologo medico di Perugia (Italia). Oggi parleremo degli attuali paradigmi per il trattamento del carcinoma del polmone non
Lucio Crinò, MD: Salve e benvenuti a questo programma. Sono Lucio Crinò, un oncologo medico di Perugia (Italia). Oggi parleremo degli attuali paradigmi per il trattamento del carcinoma del polmone non
carcinoma della mammella Prima causa di mortalità nella popolazione femminile in Occidente ( Nord Europa )
 carcinoma della mammella Prima causa di mortalità nella popolazione femminile in Occidente ( Nord Europa ) Carcinoma della mammella 37.000 nuovi casi ogni anno in Italia 2 picchi di età ( 50 70 anni )
carcinoma della mammella Prima causa di mortalità nella popolazione femminile in Occidente ( Nord Europa ) Carcinoma della mammella 37.000 nuovi casi ogni anno in Italia 2 picchi di età ( 50 70 anni )
Espressione di geni specifici per un determinato tumore
 Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Versione 30.07.2008 PROTOCOLLO DI STUDIO IRMA
 Versione 30.07.2008 PROTOCOLLO DI STUDIO IRMA CARCINOMA DELLA MAMMELLA A BASSO RISCHIO DI RECIDIVA LOCALE: IRRADIAZIONE PARZIALE E ACCELERATA CON RADIOTERAPIA CONFORMAZIONALE TRIDIMENSIONALE (3D-CRT) VS.
Versione 30.07.2008 PROTOCOLLO DI STUDIO IRMA CARCINOMA DELLA MAMMELLA A BASSO RISCHIO DI RECIDIVA LOCALE: IRRADIAZIONE PARZIALE E ACCELERATA CON RADIOTERAPIA CONFORMAZIONALE TRIDIMENSIONALE (3D-CRT) VS.
-Sinossi del Protocollo-
 -Sinossi del Protocollo- CHEMIO-IMMUNOTERAPIA INTENSIVA PER IL TRATTAMENTO IN PRIMA LINEA DI PAZIENTI ADULTI CON LINFOMA NON HODGKIN A CELLULE T PERIFERICHE (PTCL) Studio Clinico A Tipo di studio Scopo
-Sinossi del Protocollo- CHEMIO-IMMUNOTERAPIA INTENSIVA PER IL TRATTAMENTO IN PRIMA LINEA DI PAZIENTI ADULTI CON LINFOMA NON HODGKIN A CELLULE T PERIFERICHE (PTCL) Studio Clinico A Tipo di studio Scopo
Tumori: farmaco immunoterapico efficace contro cancro polmone
 1June2015 http://salute.agi.it/farmaci-eterapie/notizie/tumori_farmaco_immunoterapico_efficace_contro_cancro_polmone-201505291356-farrsa1015 Tumori: farmaco immunoterapico efficace contro cancro polmone
1June2015 http://salute.agi.it/farmaci-eterapie/notizie/tumori_farmaco_immunoterapico_efficace_contro_cancro_polmone-201505291356-farrsa1015 Tumori: farmaco immunoterapico efficace contro cancro polmone
I metodi per la misura della prognosi
 C.I. di Metodologia clinica I metodi per la misura della prognosi Obiettivo Conoscere ed utilizzare i principali strumenti per identificare i fattori di rischio e i fattori prognostici 1 Gallo C. Gallo_
C.I. di Metodologia clinica I metodi per la misura della prognosi Obiettivo Conoscere ed utilizzare i principali strumenti per identificare i fattori di rischio e i fattori prognostici 1 Gallo C. Gallo_
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
CRIZOTINIB - XALKORI
 giunta regionale Allegato A al Decreto n. 253 del 28 agosto 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CRIZOTINIB - XALKORI Indicazione in esame: é indicato per
giunta regionale Allegato A al Decreto n. 253 del 28 agosto 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CRIZOTINIB - XALKORI Indicazione in esame: é indicato per
Tossicita da chemioterapia e differenze di genere. Ilaria Pazzagli U.O.Oncologia medica P.O.Pescia Azienda USL3 Pistoia e Valdinievole
 Tossicita da chemioterapia e differenze di genere Ilaria Pazzagli U.O.Oncologia medica P.O.Pescia Azienda USL3 Pistoia e Valdinievole Tumori e genere:quali dati? Pochi dati prospettici e da trials clinici
Tossicita da chemioterapia e differenze di genere Ilaria Pazzagli U.O.Oncologia medica P.O.Pescia Azienda USL3 Pistoia e Valdinievole Tumori e genere:quali dati? Pochi dati prospettici e da trials clinici
Risultati del triage e del follow-up post-trattamento con HPV-DNA test
 Lo screening per la prevenzione dei tumori della cervice uterina in Emilia Romagna Risultati del triage e del follow-up post-trattamento con HPV-DNA test Bologna, 29 marzo 2011 HPV TEST NEL TRIAGE DI ASC-US
Lo screening per la prevenzione dei tumori della cervice uterina in Emilia Romagna Risultati del triage e del follow-up post-trattamento con HPV-DNA test Bologna, 29 marzo 2011 HPV TEST NEL TRIAGE DI ASC-US
CORSO RESIDENZIALE TEORICO - PRATICO IL CARCINOMA POLMONARE NON A PICCOLE CELLULE: DALLA DIAGNOSI AL TRATTAMENTO NELL ERA DEI FARMACI BIOMOLECOLARI
 CORSO RESIDENZIALE TEORICO - PRATICO IL CARCINOMA POLMONARE NON A PICCOLE CELLULE: DALLA DIAGNOSI AL TRATTAMENTO NELL ERA DEI FARMACI BIOMOLECOLARI 13-14 Aprile 2015 IRCCS Giovanni Paolo II, Bari RAZIONALE
CORSO RESIDENZIALE TEORICO - PRATICO IL CARCINOMA POLMONARE NON A PICCOLE CELLULE: DALLA DIAGNOSI AL TRATTAMENTO NELL ERA DEI FARMACI BIOMOLECOLARI 13-14 Aprile 2015 IRCCS Giovanni Paolo II, Bari RAZIONALE
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
MINI-REPORT - Tafluprost
 MINI-REPORT - Tafluprost PRINCIPIO ATTIVO: Tafluprost NOME COMMERCIALE: Saflutan (Merck Sharp & Dohme) FORMULAZIONE: collirio monodose- 30 fl 15 mcg/ml 0,3-priva di conservante (unico in commercio in Italia)
MINI-REPORT - Tafluprost PRINCIPIO ATTIVO: Tafluprost NOME COMMERCIALE: Saflutan (Merck Sharp & Dohme) FORMULAZIONE: collirio monodose- 30 fl 15 mcg/ml 0,3-priva di conservante (unico in commercio in Italia)
NEOPLASIE VESCICALI DALLA DIAGNOSI ALLA TERAPIA
 National Cancer Institute 2006 National Cancer Institute 2006 Classificazione anatomo-patologica Forme maligne (97%) Carcinoma a cellule di transizione (>90%) Carcinoma a cellule squamose Adenocarcinoma
National Cancer Institute 2006 National Cancer Institute 2006 Classificazione anatomo-patologica Forme maligne (97%) Carcinoma a cellule di transizione (>90%) Carcinoma a cellule squamose Adenocarcinoma
Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing. Data di inizio 24/07/2006
 ALLEGATO A Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing Principio attivo ERLOTINIB (Tarceva ) SUNITINIB (Sutent ) SORAFENIB (Nexavar
ALLEGATO A Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing Principio attivo ERLOTINIB (Tarceva ) SUNITINIB (Sutent ) SORAFENIB (Nexavar
PROTOCOLLO DELLA SPERIMENTAZIONE CLINICA
 PROTOCOLLO DELLA SPERIMENTAZIONE CLINICA Titolo Studio di fase 1/2 su brentuximab vedotin (SGN-35) in pazienti pediatrici con linfoma a grandi cellule anaplastico sistemico o linfoma di Hodgkin recidivo
PROTOCOLLO DELLA SPERIMENTAZIONE CLINICA Titolo Studio di fase 1/2 su brentuximab vedotin (SGN-35) in pazienti pediatrici con linfoma a grandi cellule anaplastico sistemico o linfoma di Hodgkin recidivo
Tumore del polmone Non Small Cell Lung Cancer, non squamoso (mantenimento dopo I linea)
 Tumore del polmone Non Small Cell Lung Cancer, non squamoso () Raccomandazioni evidence-based A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 38 Aggiornamento Direzione
Tumore del polmone Non Small Cell Lung Cancer, non squamoso () Raccomandazioni evidence-based A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 38 Aggiornamento Direzione
Criteri di scelta per la prima e seconda linea. Mariella Sorarù UO Oncologia Camposampiero
 Criteri di scelta per la prima e seconda linea Mariella Sorarù UO Oncologia Camposampiero Quali farmaci a disposizione? INIBITORI TKI: Sorafenib Sunitinib Pazopanib Axitinib INIBITORI m TOR: Temsirolimus
Criteri di scelta per la prima e seconda linea Mariella Sorarù UO Oncologia Camposampiero Quali farmaci a disposizione? INIBITORI TKI: Sorafenib Sunitinib Pazopanib Axitinib INIBITORI m TOR: Temsirolimus
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Tarceva 25 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa rivestita con
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Tarceva 25 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa rivestita con
AZIENDA OSPEDALIERA OSPEDALI RIUNITI PAPARDO- PIEMONTE
 REGIONE SICILIANA ASSESSORATO SANITA AZIENDA OSPEDALIERA OSPEDALI RIUNITI PAPARDO- PIEMONTE MESSINA UFFICIO STAMPA tel 090-3992859 Oncologia Medica AOOR Papardo-Piemonte. Il COEP, Centro Oncologico di
REGIONE SICILIANA ASSESSORATO SANITA AZIENDA OSPEDALIERA OSPEDALI RIUNITI PAPARDO- PIEMONTE MESSINA UFFICIO STAMPA tel 090-3992859 Oncologia Medica AOOR Papardo-Piemonte. Il COEP, Centro Oncologico di
CHEMIOTERAPIA ADIUVANTE NEL NSCLC IN FASE INIZIALE: SÌ, MA SENZA TRASCURARE LA QUALITÀ DI VITA
 CHEMIOTERAPIA ADIUVANTE NEL NSCLC IN FASE INIZIALE: SÌ, MA SENZA TRASCURARE LA QUALITÀ DI VITA In pazienti con carcinoma polmonare NSCLC in fase iniziale operabile, la chemioterapia adiuvante, aggiunta
CHEMIOTERAPIA ADIUVANTE NEL NSCLC IN FASE INIZIALE: SÌ, MA SENZA TRASCURARE LA QUALITÀ DI VITA In pazienti con carcinoma polmonare NSCLC in fase iniziale operabile, la chemioterapia adiuvante, aggiunta
Versione aggiornata al 1 agosto 2003
 Versione aggiornata al 1 agosto 2003 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI FEGATO.
Versione aggiornata al 1 agosto 2003 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI FEGATO.
Il carcinoma del polmone è associato a una sopravvivenza globale a 5 anni del 10-12%
 Il carcinoma del polmone è associato a una sopravvivenza globale a 5 anni del 10-12% Al momento della diagnosi solo il 10-15% dei soggetti con carcinoma del polmone ha una forma localizzata. Di questi,
Il carcinoma del polmone è associato a una sopravvivenza globale a 5 anni del 10-12% Al momento della diagnosi solo il 10-15% dei soggetti con carcinoma del polmone ha una forma localizzata. Di questi,
Stefania Corso 17 ANNI. Una lotta durata una vita
 Stefania Corso 17 ANNI Una lotta durata una vita Stefania Corso, 17 anni Copyright 2015 Edizioni del Faro Gruppo Editoriale Tangram Srl Via Verdi, 9/A 38122 Trento www.edizionidelfaro.it info@edizionidelfaro.it
Stefania Corso 17 ANNI Una lotta durata una vita Stefania Corso, 17 anni Copyright 2015 Edizioni del Faro Gruppo Editoriale Tangram Srl Via Verdi, 9/A 38122 Trento www.edizionidelfaro.it info@edizionidelfaro.it
Verranno inoltre effettuati: - HCV Ab - CMV IgG, - Toxoplasma IgG - EBV VCA-IgG, EBNA - HSV IgG - VZV IgG
 Versione approvata al 1marzo 2005 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI CUORE E/O POLMONE
Versione approvata al 1marzo 2005 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI CUORE E/O POLMONE
Paola Capelli Sara Pecori U.O. di Anatomia Patologica Policlinico Borgo Roma
 Verona, 23-24 novembre 2010 Problematiche, funzionalità intestinale e recidive post-chirurgiche. Fattori patologici di risposta alla terapia Paola Capelli Sara Pecori U.O. di Anatomia Patologica Policlinico
Verona, 23-24 novembre 2010 Problematiche, funzionalità intestinale e recidive post-chirurgiche. Fattori patologici di risposta alla terapia Paola Capelli Sara Pecori U.O. di Anatomia Patologica Policlinico
GP2013. Sinossi del protocollo dello studio CIGG013A2301J
 GP2013 dello studio CIGG013A2301J Studio randomizzato, controllato, in doppio cieco, di Fase III, per confrontare l efficacia, la sicurezza d impiego e la farmacocinetica di GP2013 in associazione a ciclofosfamide,
GP2013 dello studio CIGG013A2301J Studio randomizzato, controllato, in doppio cieco, di Fase III, per confrontare l efficacia, la sicurezza d impiego e la farmacocinetica di GP2013 in associazione a ciclofosfamide,
PROTOCOLLO PER L'UTILIZZO DI DONATORI anti-hcv + IN PAZIENTI anti-hcv + NEL TRAPIANTO DI RENE
 Versione aggiornata al 1 agosto 2003 PROTOCOLLO PER L'UTILIZZO DI DONATORI anti-hcv + IN PAZIENTI anti-hcv + NEL TRAPIANTO DI RENE Principi generali Razionale La carenza di donatori d organo rappresenta
Versione aggiornata al 1 agosto 2003 PROTOCOLLO PER L'UTILIZZO DI DONATORI anti-hcv + IN PAZIENTI anti-hcv + NEL TRAPIANTO DI RENE Principi generali Razionale La carenza di donatori d organo rappresenta
CONFIDENZIALE NCIC CTG BR.26 Sinossi 6 agosto 2009 Versione 20100131
 Pagina 1 di 9 STUDIO RANDOMIZZATO, IN DOPPIO CIECO, CONTROLLATO CON PLACEBO, SU PF-00299804 (PF-804) IN PAZIENTI CON CARCINOMA POLMONARE NON A PICCOLE CELLULE INCURABILE, DI STADIO IIIB/IV, DOPO FALLIMENTO
Pagina 1 di 9 STUDIO RANDOMIZZATO, IN DOPPIO CIECO, CONTROLLATO CON PLACEBO, SU PF-00299804 (PF-804) IN PAZIENTI CON CARCINOMA POLMONARE NON A PICCOLE CELLULE INCURABILE, DI STADIO IIIB/IV, DOPO FALLIMENTO
Esercitazione n. 5 di Metodologia della Ricerca Psicologica
 Esercitazione n. di Metodologia della Ricerca Psicologica Quesito 1: Un ricercatore intende studiare la conoscenza e gli atteggiamenti che hanno gli operatori del diritto delle applicazioni psicogiuridiche.
Esercitazione n. di Metodologia della Ricerca Psicologica Quesito 1: Un ricercatore intende studiare la conoscenza e gli atteggiamenti che hanno gli operatori del diritto delle applicazioni psicogiuridiche.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE ALIMTA 100 mg polvere per concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE ALIMTA 100 mg polvere per concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
